よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
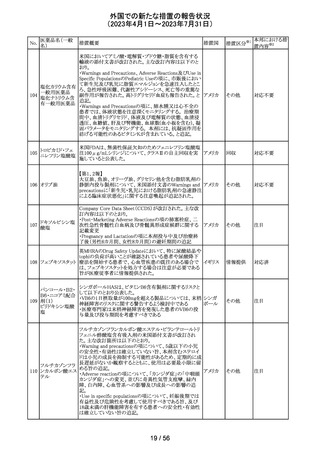
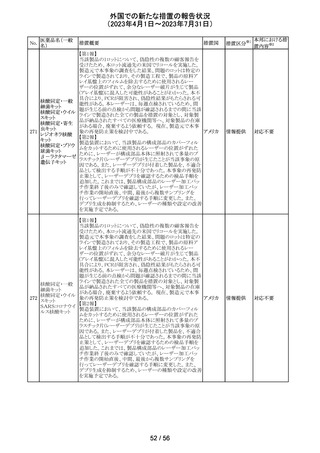
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
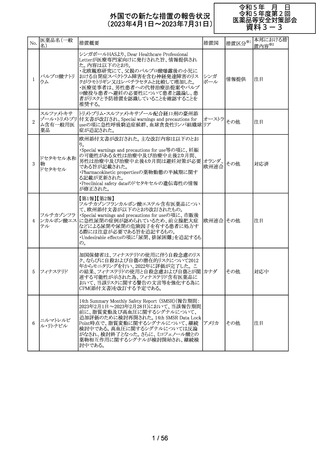
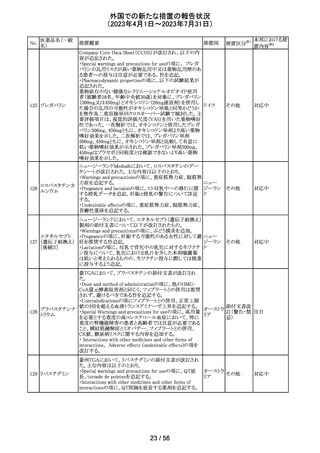
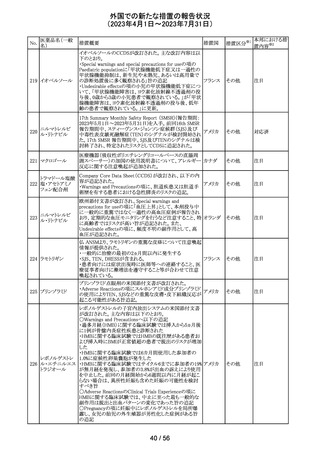
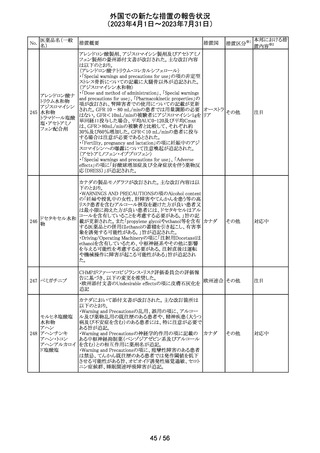
米国において、プレスリリース及び治験責任医師宛てのレ
ターが発出された。主な内容は以下のとおり。
・LEAP-017試験*について、主要評価項目である全生存
期間を達成しなかった。本試験の最終解析において、本併
用療法はOSの改善傾向を示したものの、事前に定められ
た統計学的有意性の基準を満たさなかった。
*LEAP-017試験:前治療中若しくは前治療後に進行した
又は前治療に不耐容となった転移性結腸・直腸癌患者を
対象にレンバチニブとペムブロリズマブの併用療法を標準
治療と比較する無作為化第Ⅲ相試験
・重要な副次評価項目である無増悪生存期間、奏効率及
び奏効期間については、本併用療法は改善傾向を示し
た。ただし、事前に定められた統計解析計画に従い、統計
学的有意性は検証されなかった。
・本併用療法の安全性プロファイルは、これまでに報告され
レンバチニブメシ
47
ているものと同様であり、新たな安全性シグナルは確認さ アメリカ
ル酸塩
れなかった。
・本試験治療を継続している被験者に推奨される措置が以
下のとおり通知された。
・治験責任医師の評価において、レンバチニブとペムブロ
リズマブの併用が有益であると判断された被験者のみが、
本併用療法の投薬を継続することができる。これらの被験
者は、治験実施計画書に基づいた中止基準に該当するま
で、全ての試験手順を継続する必要がある。
・対照群(レゴラフェニブ又はTAS-102投与群)の被験者
は、中止基準に該当するまで、治験実施計画書に従って
試験治療を継続することができる。
・上記の確認が行われたことを被験者のカルテに記録す
る。
・試験の変更を反映するために治験実施計画書の改訂が
予定されている。
措置区分※1
本邦における措
置内容※2
情報提供
対応不要
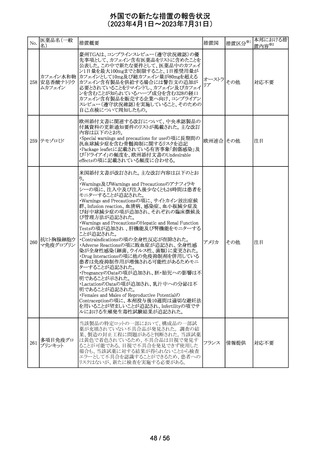
【第1、2報】
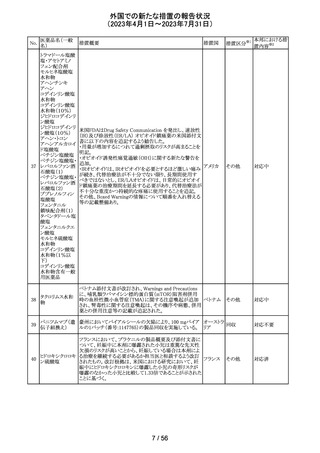
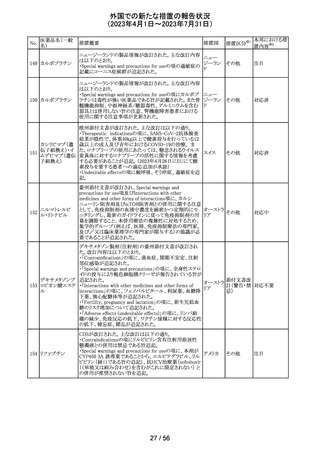
欧州において、HMG原薬の製造で承認されていない工程
変更が確認されたことから、製造工程変更に起因する直接
ヒト下垂体性性腺
48
的な安全性問題は認められていないものの、予防的措置と 欧州連合 その他
刺激ホルモン
して企業による出荷停止が行われ、供給が差し止めとなっ
ているEU加盟国及びDear Healthcare Professional Letter
が公表された。
49 アブロシチニブ
サイバインコ錠のCDSが以下のとおり改訂されたもの。
・Posology and method of administrationの項について、静
脈血栓塞栓症(VTE)、主要な心血管系事象(MACE)又は
悪性腫瘍のリスクを有する患者に対する用法・用量につい
て追記(これらのリスクを有する患者では100mgから開始し、
効果不十分な場合に200mgに増量することを推奨)。
・Special warnings and precautions for useの項について、 アメリカ
VTEのリスクを有する患者では定期的にVTEの兆候や症状
等を確認し、もしVTEの兆候や症状があらわれた場合には
投与中止するよう追記。また、MACE又は悪性腫瘍のリスク
を有する患者に対しては慎重に使用するよう追記。
・Undesirable effectsの項について、「肺塞栓症を含む血栓
症の事象」を「静脈血栓塞栓症」に変更。
その他
注目
アメリカ
回収
対応不要
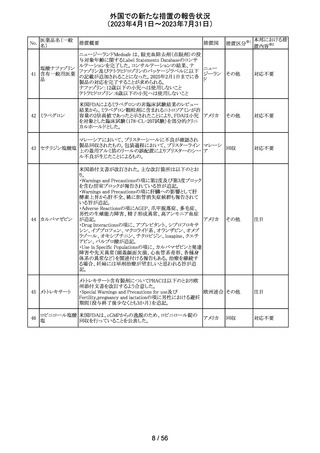
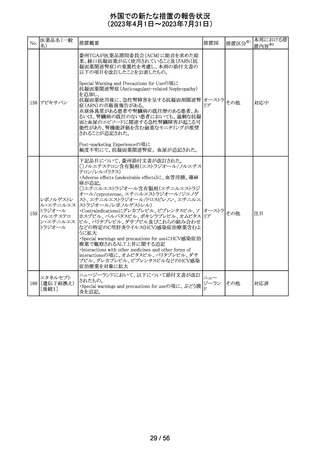
米国においてモンテルカストナトリウム細粒の不純物の規
モンテルカストナ
格が不適合であったことから、FDAにより製品回収がなされ アメリカ
トリウム
たもの。
回収
対応不要
ベバシズマブ(遺
50 伝子組換え)[後 米国において特定ロットの製品を回収中
続4]
51
対応不要
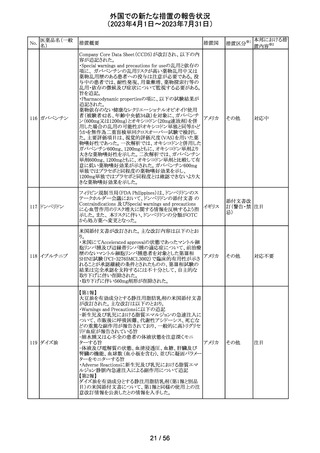
9 / 56
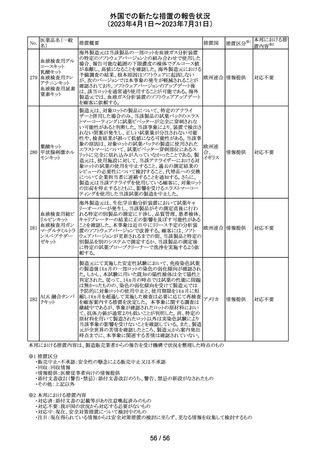
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
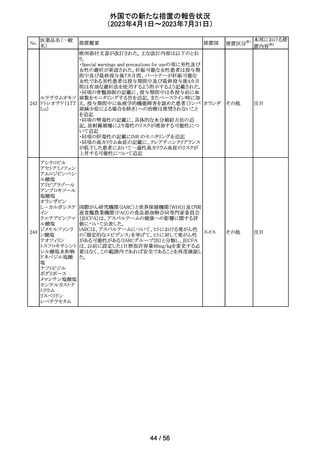
米国において、プレスリリース及び治験責任医師宛てのレ
ターが発出された。主な内容は以下のとおり。
・LEAP-017試験*について、主要評価項目である全生存
期間を達成しなかった。本試験の最終解析において、本併
用療法はOSの改善傾向を示したものの、事前に定められ
た統計学的有意性の基準を満たさなかった。
*LEAP-017試験:前治療中若しくは前治療後に進行した
又は前治療に不耐容となった転移性結腸・直腸癌患者を
対象にレンバチニブとペムブロリズマブの併用療法を標準
治療と比較する無作為化第Ⅲ相試験
・重要な副次評価項目である無増悪生存期間、奏効率及
び奏効期間については、本併用療法は改善傾向を示し
た。ただし、事前に定められた統計解析計画に従い、統計
学的有意性は検証されなかった。
・本併用療法の安全性プロファイルは、これまでに報告され
レンバチニブメシ
47
ているものと同様であり、新たな安全性シグナルは確認さ アメリカ
ル酸塩
れなかった。
・本試験治療を継続している被験者に推奨される措置が以
下のとおり通知された。
・治験責任医師の評価において、レンバチニブとペムブロ
リズマブの併用が有益であると判断された被験者のみが、
本併用療法の投薬を継続することができる。これらの被験
者は、治験実施計画書に基づいた中止基準に該当するま
で、全ての試験手順を継続する必要がある。
・対照群(レゴラフェニブ又はTAS-102投与群)の被験者
は、中止基準に該当するまで、治験実施計画書に従って
試験治療を継続することができる。
・上記の確認が行われたことを被験者のカルテに記録す
る。
・試験の変更を反映するために治験実施計画書の改訂が
予定されている。
措置区分※1
本邦における措
置内容※2
情報提供
対応不要
【第1、2報】
欧州において、HMG原薬の製造で承認されていない工程
変更が確認されたことから、製造工程変更に起因する直接
ヒト下垂体性性腺
48
的な安全性問題は認められていないものの、予防的措置と 欧州連合 その他
刺激ホルモン
して企業による出荷停止が行われ、供給が差し止めとなっ
ているEU加盟国及びDear Healthcare Professional Letter
が公表された。
49 アブロシチニブ
サイバインコ錠のCDSが以下のとおり改訂されたもの。
・Posology and method of administrationの項について、静
脈血栓塞栓症(VTE)、主要な心血管系事象(MACE)又は
悪性腫瘍のリスクを有する患者に対する用法・用量につい
て追記(これらのリスクを有する患者では100mgから開始し、
効果不十分な場合に200mgに増量することを推奨)。
・Special warnings and precautions for useの項について、 アメリカ
VTEのリスクを有する患者では定期的にVTEの兆候や症状
等を確認し、もしVTEの兆候や症状があらわれた場合には
投与中止するよう追記。また、MACE又は悪性腫瘍のリスク
を有する患者に対しては慎重に使用するよう追記。
・Undesirable effectsの項について、「肺塞栓症を含む血栓
症の事象」を「静脈血栓塞栓症」に変更。
その他
注目
アメリカ
回収
対応不要
米国においてモンテルカストナトリウム細粒の不純物の規
モンテルカストナ
格が不適合であったことから、FDAにより製品回収がなされ アメリカ
トリウム
たもの。
回収
対応不要
ベバシズマブ(遺
50 伝子組換え)[後 米国において特定ロットの製品を回収中
続4]
51
対応不要
9 / 56