よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (27 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
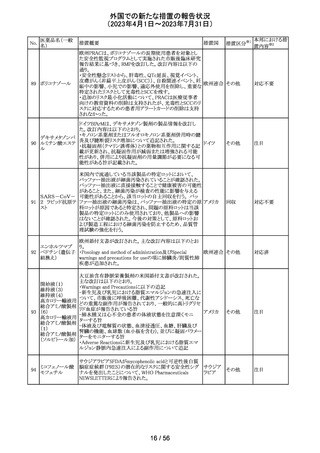
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
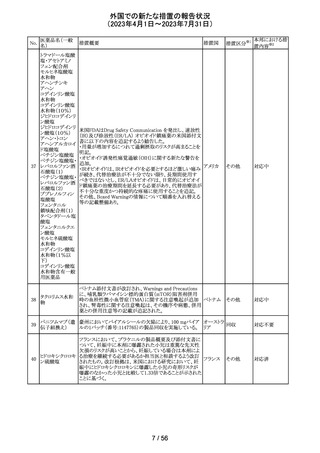
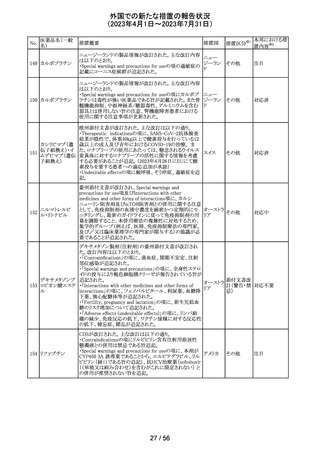
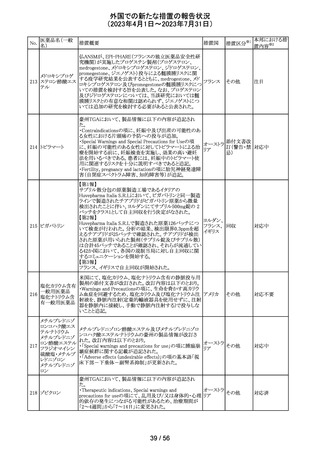
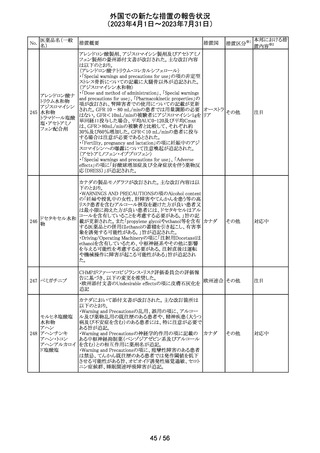
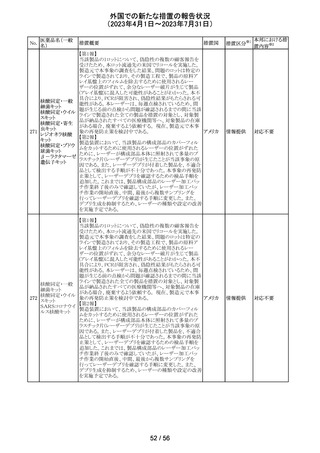
149 カルボプラチン
ニュージーランドの製品情報が改訂された。主な改訂内容
ニュー
は以下のとおり。
ジーラン その他
・Special warnings and precautions for useの項の過敏症の
ド
記載にコーニス症候群が追記された。
注目
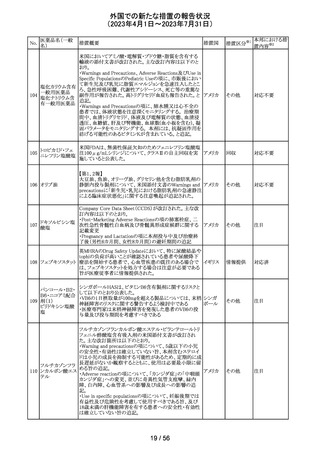
150 カルボプラチン
ニュージーランドの製品情報が改訂された。主な改訂内容
は以下のとおり。
・Special warnings and precautions for useの項にカルボプ ニュー
ラチンは毒性が強い医薬品である旨が記載された。また骨 ジーラン その他
髄機能抑制、中枢神経系/聴器毒性、アルミニウムを含む ド
器具とは併用しない旨の注意、腎機能障害患者における
使用に関する注意事項が更新された。
対応済
欧州添付文書が改訂された。主な改訂は以下の通り。
・Therapeutic indicationsの項に、SARS-CoV-2抗体検査
結果が陰性で、体重40kg以上で酸素投与を行っている12
カシリビマブ(遺 歳以上の成人及び青年におけるCOVID-19の治療。 ま
伝子組換え)・イ た、ロナプリーブの使用にあたっては、懸念されるウイルス
151
スイス
ムデビマブ(遺伝 変異体に対するロナプリーブの活性に関する情報を考慮
子組換え)
する必要があることが追記。(2023年4月26日にEUにて酸
素投与を要する患者への適応追加が承認)
・Undesirable effectsの項に頻呼吸、そう痒症、過敏症を追
記。
152
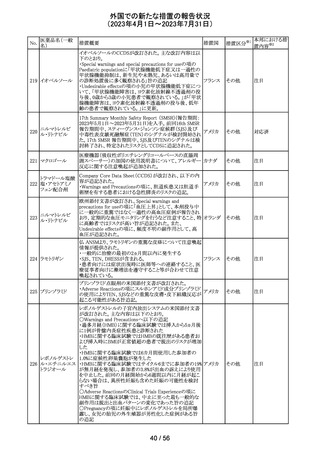
ニルマトレルビ
ル・リトナビル
その他
対応済
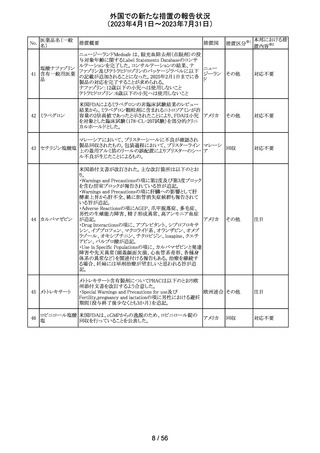
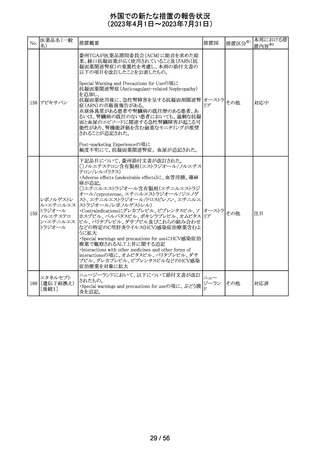
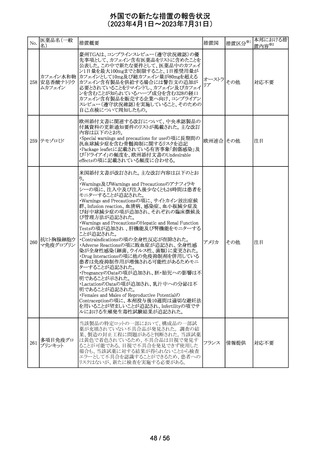
豪州添付文書が改訂され、Special warnings and
precautions for use項及びInteractions with other
medicines and other forms of interactions項に、カルシ
ニューリン阻害剤及びmTOR阻害剤との併用に関する注意
として、免疫抑制剤の血清中濃度を綿密かつ定期的にモ オーストラ
その他
ニタリングし、最新のガイドラインに従って免疫抑制剤の用 リア
量を調節すること、本併用療法の複雑性に対処するため、
集学的グループ(例えば、医師、免疫抑制療法の専門家、
及び/又は臨床薬理学の専門家が関与する)の協議が必
要であることが追記された。
対応中
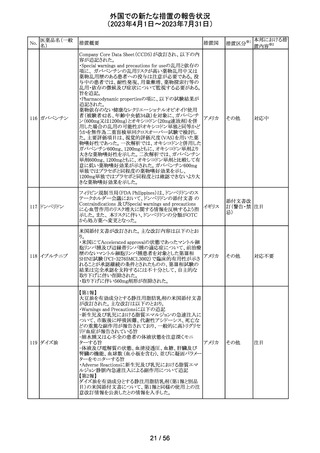
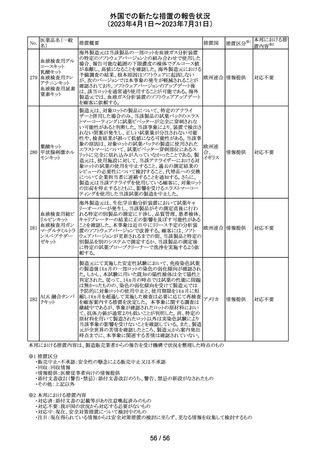
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂され
た。改訂内容は以下のとおり。
・「Contraindications」の項に、菌血症、関節不安定、注射
部位感染が追記された。
・「Special warnings and precautions」の項に、全身性ステロ
イドの投与により褐色細胞腫クリーゼが報告されている旨が
デキサメタゾンプ 追記された。
添付文書改
オーストラ
153 ロピオン酸エステ ・「Interactions with other medicines and other forms of
訂(警告・禁 対応不要
リア
ル
interactions」の項に、フェノバルビタール、利尿薬、血糖降
忌)
下薬、強心配糖体等が追記された。
・「Fertility, pregnancy and lactation」の項に、新生児低血
糖のリスク増加について追記された。
・「Adverse effects (undesirable effects)」の項に、リンパ組
織の減少、免疫反応の低下、ワクチン接種に対する反応性
の低下、健忘症、錯乱が追記された。
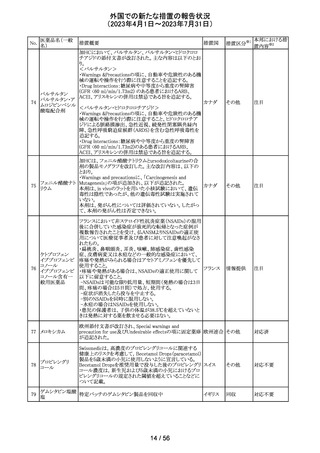
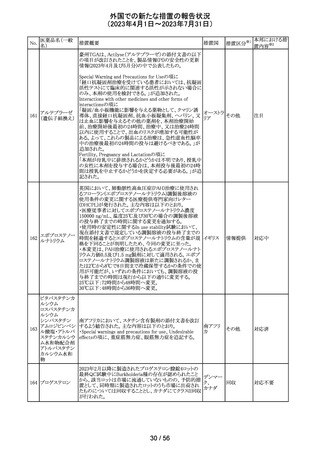
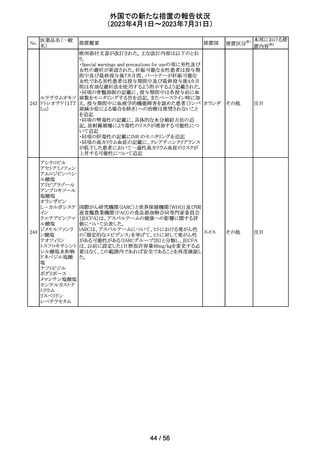
154 リファブチン
CDSが改訂された。主な改訂は以下の通り。
・Contraindicationsの項にリルピビリン含有注射用徐放性
懸濁液との併用は禁忌である旨追記。
・Special warnings and precautions for useの項に、本剤が
アメリカ
CYP450 3A 誘導薬であることから、エルビテグラビル、リル
ピビリン(経口である旨の追記)、抗HCV治療薬(sofosbuvir
((単独又は組み合わせ)を含むがこれに限定されない) と
の併用が推奨されない旨を追記。
27 / 56
その他
注目
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
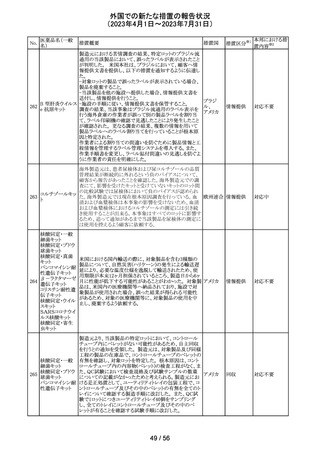
149 カルボプラチン
ニュージーランドの製品情報が改訂された。主な改訂内容
ニュー
は以下のとおり。
ジーラン その他
・Special warnings and precautions for useの項の過敏症の
ド
記載にコーニス症候群が追記された。
注目
150 カルボプラチン
ニュージーランドの製品情報が改訂された。主な改訂内容
は以下のとおり。
・Special warnings and precautions for useの項にカルボプ ニュー
ラチンは毒性が強い医薬品である旨が記載された。また骨 ジーラン その他
髄機能抑制、中枢神経系/聴器毒性、アルミニウムを含む ド
器具とは併用しない旨の注意、腎機能障害患者における
使用に関する注意事項が更新された。
対応済
欧州添付文書が改訂された。主な改訂は以下の通り。
・Therapeutic indicationsの項に、SARS-CoV-2抗体検査
結果が陰性で、体重40kg以上で酸素投与を行っている12
カシリビマブ(遺 歳以上の成人及び青年におけるCOVID-19の治療。 ま
伝子組換え)・イ た、ロナプリーブの使用にあたっては、懸念されるウイルス
151
スイス
ムデビマブ(遺伝 変異体に対するロナプリーブの活性に関する情報を考慮
子組換え)
する必要があることが追記。(2023年4月26日にEUにて酸
素投与を要する患者への適応追加が承認)
・Undesirable effectsの項に頻呼吸、そう痒症、過敏症を追
記。
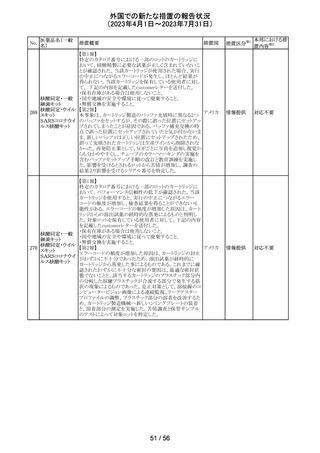
152
ニルマトレルビ
ル・リトナビル
その他
対応済
豪州添付文書が改訂され、Special warnings and
precautions for use項及びInteractions with other
medicines and other forms of interactions項に、カルシ
ニューリン阻害剤及びmTOR阻害剤との併用に関する注意
として、免疫抑制剤の血清中濃度を綿密かつ定期的にモ オーストラ
その他
ニタリングし、最新のガイドラインに従って免疫抑制剤の用 リア
量を調節すること、本併用療法の複雑性に対処するため、
集学的グループ(例えば、医師、免疫抑制療法の専門家、
及び/又は臨床薬理学の専門家が関与する)の協議が必
要であることが追記された。
対応中
デキサメタゾン製剤(注射剤)の豪州添付文書が改訂され
た。改訂内容は以下のとおり。
・「Contraindications」の項に、菌血症、関節不安定、注射
部位感染が追記された。
・「Special warnings and precautions」の項に、全身性ステロ
イドの投与により褐色細胞腫クリーゼが報告されている旨が
デキサメタゾンプ 追記された。
添付文書改
オーストラ
153 ロピオン酸エステ ・「Interactions with other medicines and other forms of
訂(警告・禁 対応不要
リア
ル
interactions」の項に、フェノバルビタール、利尿薬、血糖降
忌)
下薬、強心配糖体等が追記された。
・「Fertility, pregnancy and lactation」の項に、新生児低血
糖のリスク増加について追記された。
・「Adverse effects (undesirable effects)」の項に、リンパ組
織の減少、免疫反応の低下、ワクチン接種に対する反応性
の低下、健忘症、錯乱が追記された。
154 リファブチン
CDSが改訂された。主な改訂は以下の通り。
・Contraindicationsの項にリルピビリン含有注射用徐放性
懸濁液との併用は禁忌である旨追記。
・Special warnings and precautions for useの項に、本剤が
アメリカ
CYP450 3A 誘導薬であることから、エルビテグラビル、リル
ピビリン(経口である旨の追記)、抗HCV治療薬(sofosbuvir
((単独又は組み合わせ)を含むがこれに限定されない) と
の併用が推奨されない旨を追記。
27 / 56
その他
注目