よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
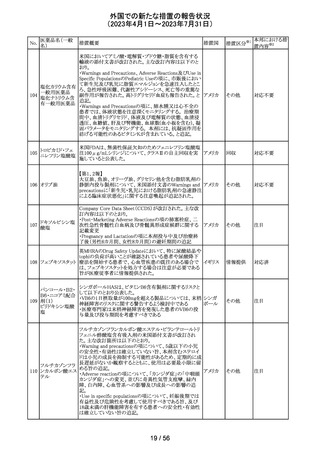
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
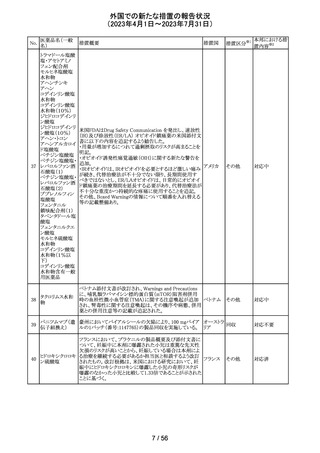
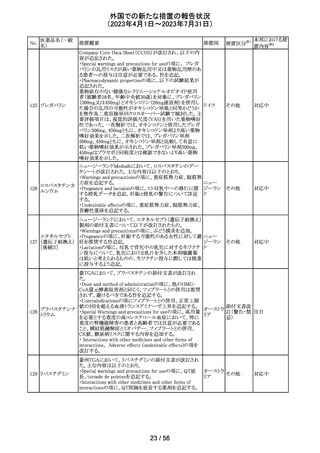
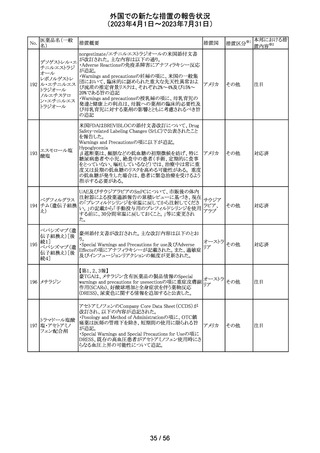
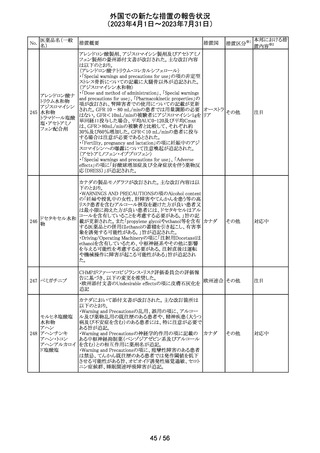
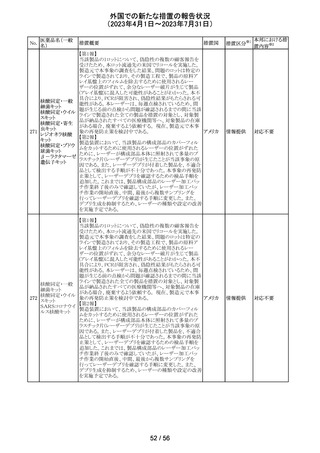
256 エゼチミブ
257
ニルマトレルビ
ル・リトナビル
措置概要
措置国
措置区分※1
本邦における措
置内容※2
米国FDAは、エゼチミブの添付文書を改訂した。主な内容
は以下のとおり。
Contraindicationsの項
①エゼチミブまたはエゼチミブに含まれる賦形剤に対する
過敏症が知られている患者には禁忌である旨を追記する。
②スタチン、フェノフィブラートまたは他のLDL-C低下療法
と併用する場合、エゼチミブは、スタチン、フェノフィブラー
トまたは他のLDL-C低下療法が禁忌である患者には禁忌
であることを追加する。
Warnings and Precautionsの項
③Risks Associated with Combination Treatment with a
Statin, Fenofibrate, or Other LDL-C Lowering Therapies
の項に、他のLDL-C低下剤と併用する場合には、これらの
薬剤の処方情報を参照し、Warnings and Precautionsを含
むがこれらに限定されないリスクについて説明することを追
記する。
④Liver Enzymesの項に、血清トランスアミナーゼが増加す
る旨、肝機能検査を実施し、AST、ALTが施設基準値の3
倍を超える場合は中止を検討する旨を追記する。
⑤Myopathy/Rhabdomyolysisの項に、ミオパシーの症状(ク アメリカ
レアチンキナーゼ(CK)上昇に伴う筋肉痛、圧痛、脱力感)
を追記し、ミオパシーが疑われる場合は、必要に応じてエ
ゼチミブ及び他の併用薬を中止することを追記する。
Adverse ReactionsのPostmarketing Reactionsの項に、以下
を追記する。
⑥血液障害:血小板減少症
⑦胃腸障害:腹痛、膵炎、吐き気
⑧肝胆道障害:肝トランスアミナーゼ上昇、肝炎、 胆石症、
胆嚢炎
⑨皮膚および皮下組織障害:多型紅斑
⑩Drug Interactionsの項をTable形式に記載変更する。
⑪Pregnancy及びLactationの項をPLRに基づき変更する。
⑫Pediatric Useの項に、エゼチミブの安全性と有効性は、
HeFHまたは HoFHの10 歳未満の小児患者、ホモ接合性
家族性シトステロール血症の9歳未満の小児患者、または
他の種類の高脂血症の小児患者では確立されていない旨
を追記する。
⑬Geriatric Useの項に、高齢者と若年成人とで薬物動態
に差が認められなかった旨を追記する。
添付文書改
訂(警告・禁 注目
忌)
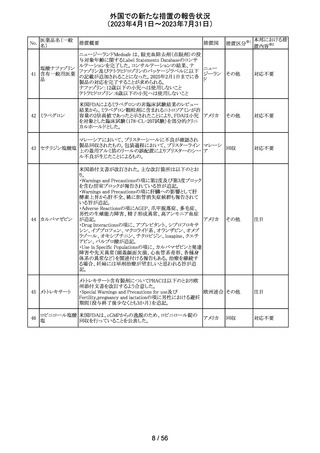
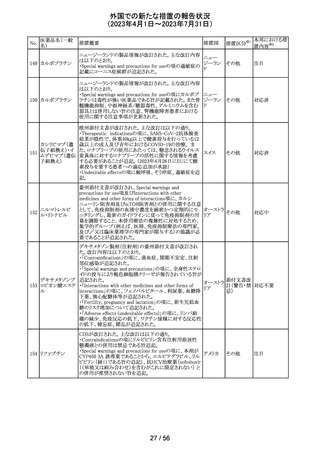
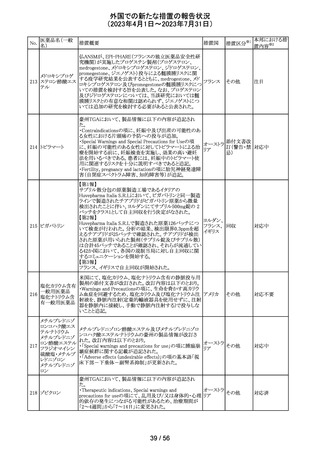
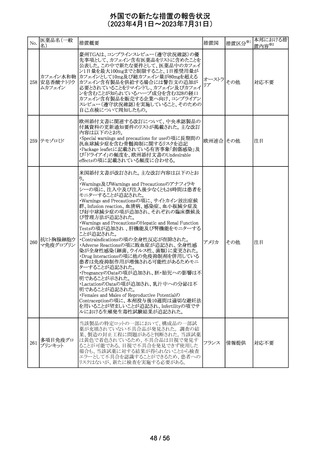
カナダ添付文書が改訂された。主な改訂は以下の通り。
・Contraindications の項に併用禁忌の薬剤として、シロドシ
ン、エプレレノン、イバブラジン、エレトリプタン、Uogepant、
フィネレノン、Nloxegol、Fibanserin、トルバプタン、中止直
後に本剤を開始してはいけないCYP3A誘導剤として、プリ
ミドン、Lumacaftor/ivacaftorを追記。
・Drug interactionsの項の臨床的に重要な薬物相互作用の
リストに、タムスロシン、Hydrocodone、オキシコドン、
Meperidine、トラマドール、Propoxyphenea、メサドン、セリチ
ニブ、Ivosidenib、アピキサバン、ダビガトラン、クロナゼパ
ム、エトスクシミド、Divalproex、ラモトリギン、Bupropion、イ
サブコナゾニウム硫酸塩、ボリコナゾール、エリスロマイシ
カナダ
ン、アムロジピン、フェロジピン、ニカルジピン、アリスキレ
ン、チカグレロル、Vorapaxar、クロピドグレル、サキサグリプ
チン、Elbasvir/grazoprevir、グレカプレビル・ピブレンタスビ
ル、Sofosbuvir/velpatasvir/voxilaprevir、ジドブジン、エムト
リシタビン、ネビラピン、ビクテグラビル、シクロスポリン、タク
ロリムス、エベロリムス、シロリムス、rapamycin、トファシチニ
ブ、サルメテロール、darifenacin、クロザピン、スボレキサン
ト、アリピプラゾール、ブレクスピプラゾール、Cariprazine、
Iloperidone、Lumateperone、pimavanserin、タダラフィルを
追記。
・Adverse reactionsの項にアナフィラキシーと高血圧を追
記。
添付文書改
訂(警告・禁 注目
忌)
47 / 56
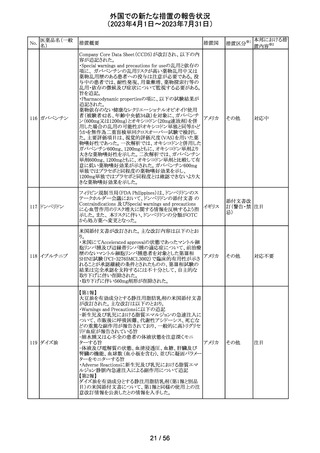
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
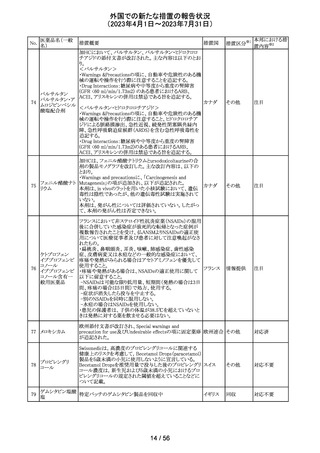
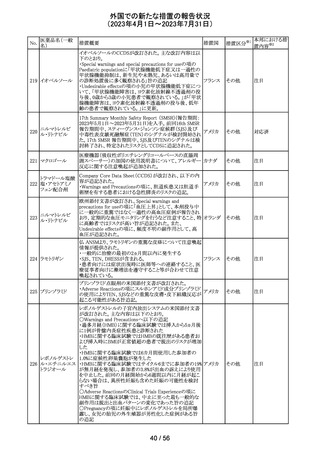
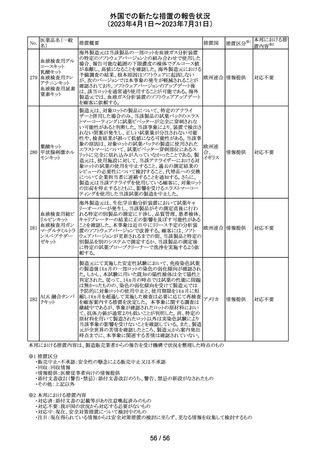
256 エゼチミブ
257
ニルマトレルビ
ル・リトナビル
措置概要
措置国
措置区分※1
本邦における措
置内容※2
米国FDAは、エゼチミブの添付文書を改訂した。主な内容
は以下のとおり。
Contraindicationsの項
①エゼチミブまたはエゼチミブに含まれる賦形剤に対する
過敏症が知られている患者には禁忌である旨を追記する。
②スタチン、フェノフィブラートまたは他のLDL-C低下療法
と併用する場合、エゼチミブは、スタチン、フェノフィブラー
トまたは他のLDL-C低下療法が禁忌である患者には禁忌
であることを追加する。
Warnings and Precautionsの項
③Risks Associated with Combination Treatment with a
Statin, Fenofibrate, or Other LDL-C Lowering Therapies
の項に、他のLDL-C低下剤と併用する場合には、これらの
薬剤の処方情報を参照し、Warnings and Precautionsを含
むがこれらに限定されないリスクについて説明することを追
記する。
④Liver Enzymesの項に、血清トランスアミナーゼが増加す
る旨、肝機能検査を実施し、AST、ALTが施設基準値の3
倍を超える場合は中止を検討する旨を追記する。
⑤Myopathy/Rhabdomyolysisの項に、ミオパシーの症状(ク アメリカ
レアチンキナーゼ(CK)上昇に伴う筋肉痛、圧痛、脱力感)
を追記し、ミオパシーが疑われる場合は、必要に応じてエ
ゼチミブ及び他の併用薬を中止することを追記する。
Adverse ReactionsのPostmarketing Reactionsの項に、以下
を追記する。
⑥血液障害:血小板減少症
⑦胃腸障害:腹痛、膵炎、吐き気
⑧肝胆道障害:肝トランスアミナーゼ上昇、肝炎、 胆石症、
胆嚢炎
⑨皮膚および皮下組織障害:多型紅斑
⑩Drug Interactionsの項をTable形式に記載変更する。
⑪Pregnancy及びLactationの項をPLRに基づき変更する。
⑫Pediatric Useの項に、エゼチミブの安全性と有効性は、
HeFHまたは HoFHの10 歳未満の小児患者、ホモ接合性
家族性シトステロール血症の9歳未満の小児患者、または
他の種類の高脂血症の小児患者では確立されていない旨
を追記する。
⑬Geriatric Useの項に、高齢者と若年成人とで薬物動態
に差が認められなかった旨を追記する。
添付文書改
訂(警告・禁 注目
忌)
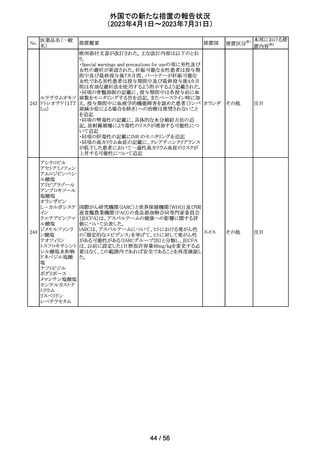
カナダ添付文書が改訂された。主な改訂は以下の通り。
・Contraindications の項に併用禁忌の薬剤として、シロドシ
ン、エプレレノン、イバブラジン、エレトリプタン、Uogepant、
フィネレノン、Nloxegol、Fibanserin、トルバプタン、中止直
後に本剤を開始してはいけないCYP3A誘導剤として、プリ
ミドン、Lumacaftor/ivacaftorを追記。
・Drug interactionsの項の臨床的に重要な薬物相互作用の
リストに、タムスロシン、Hydrocodone、オキシコドン、
Meperidine、トラマドール、Propoxyphenea、メサドン、セリチ
ニブ、Ivosidenib、アピキサバン、ダビガトラン、クロナゼパ
ム、エトスクシミド、Divalproex、ラモトリギン、Bupropion、イ
サブコナゾニウム硫酸塩、ボリコナゾール、エリスロマイシ
カナダ
ン、アムロジピン、フェロジピン、ニカルジピン、アリスキレ
ン、チカグレロル、Vorapaxar、クロピドグレル、サキサグリプ
チン、Elbasvir/grazoprevir、グレカプレビル・ピブレンタスビ
ル、Sofosbuvir/velpatasvir/voxilaprevir、ジドブジン、エムト
リシタビン、ネビラピン、ビクテグラビル、シクロスポリン、タク
ロリムス、エベロリムス、シロリムス、rapamycin、トファシチニ
ブ、サルメテロール、darifenacin、クロザピン、スボレキサン
ト、アリピプラゾール、ブレクスピプラゾール、Cariprazine、
Iloperidone、Lumateperone、pimavanserin、タダラフィルを
追記。
・Adverse reactionsの項にアナフィラキシーと高血圧を追
記。
添付文書改
訂(警告・禁 注目
忌)
47 / 56