よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
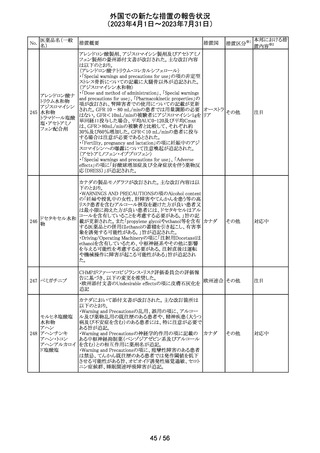
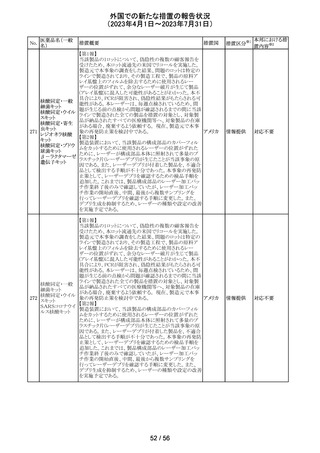
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
措置区分※1
本邦における措
置内容※2
その他
注目
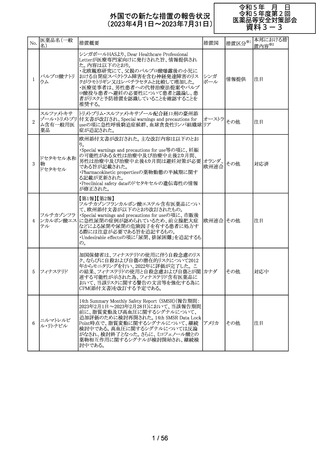
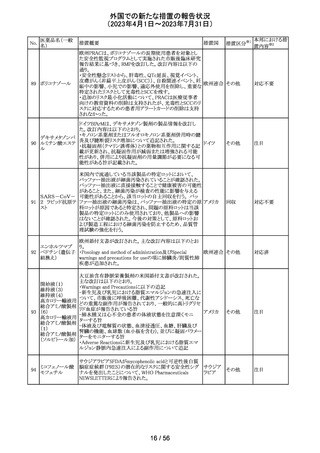
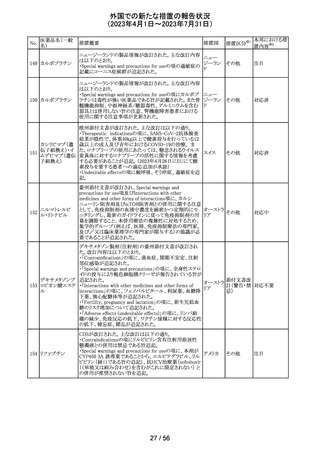
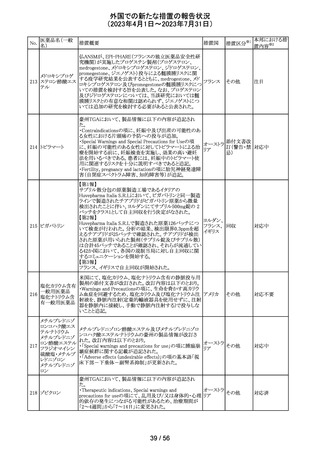
【第1報】
レルゴリクスのCCDS及び米国添付文書が改訂された。主
な変更点は以下の通り。
・Contraindicationsの項にレルゴリクス又は製品成分のいず
れかに重篤な過敏症のある患者には禁忌である旨追記。
・Warnings and PrecautionsのHypersensitivity Reactionsの
項に、レルゴリクスまたは製品成分に対して重篤な過敏症
を有する患者には禁忌である旨の追記。
・Adverse Reactionsの項に、血管浮腫を追記。
レルゴリクス
・Postmarketing Experienceの項に、血管浮腫及び蕁麻疹 オーストラ
ノルエチステロ
を含む過敏症に関する記載を追記。
リア、
33
その他
ン・エチニルエス 【第2報】
アメリカ、
トラジオール
レルゴリクス/酢酸ノルエチステロン/エストラジオールヘミ水 欧州連合
和物の欧州添付文書が改訂された。主な変更点は以下の
とおり。
Undesirable effectsの項に蕁麻疹及び血管浮腫が追記さ
れた。
【第3報】
エストラジオール/ノルエチステロン/レルゴリクスの豪州添
付文書が改訂された。主な内容は以下のとおり。
Adverse effects (undesirable effects)に、血管浮腫、蕁麻疹
が追記。
注目
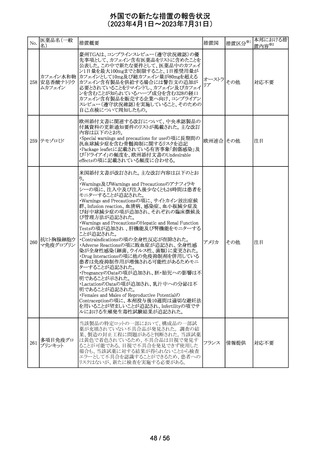
No.
医薬品名(一般
名)
措置概要
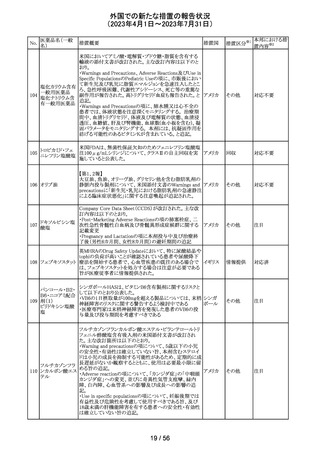
措置国
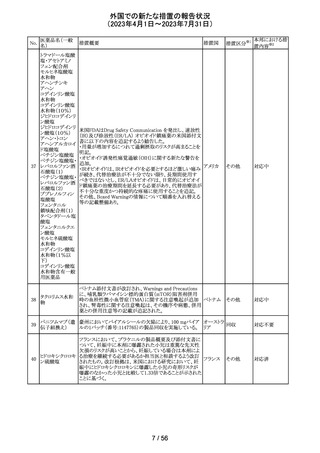
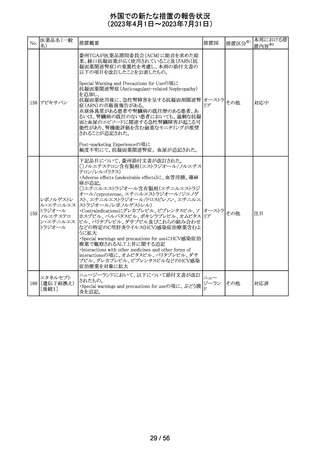
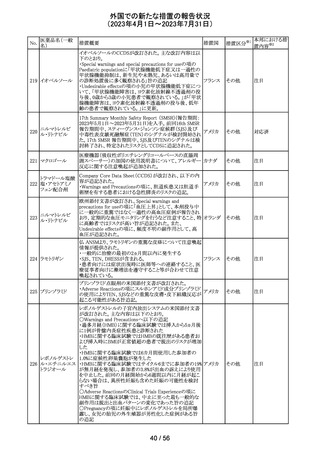
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2023/2/16~2023/3/15)を入手
した。報告対象期間に入手したBNT162b2の安全性及び有
効性データから、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
3. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジ
メント及びファーマコヴィジランス計画で反映された重要な
リスク及び不足情報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜
炎
コロナウイルス修
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチ
飾ウリジンRNAワ
32
ン関連の呼吸器疾患増強、ギラン・バレー症候群
アメリカ
クチン(SARS-
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
CoV-2)
のある患者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、
循環器疾患、活動性結核など)、自己免疫疾患患者又は
炎症性疾患患者、他のワクチンとの相互作用、長期安全性
データ、6カ月未満の乳児、ワクチンの有効性
4. OVERVIEW OF SAFETY SIGNALS DURING THE
REPORTING INTERVAL
報告対象期間中に対処もしくは評価中であったシグナルと
して以下が記載。
月経障害(Menstrual Irregularities):Not yet determined
(Ongoing)
筋炎(Myositis):No Risk(Closed)
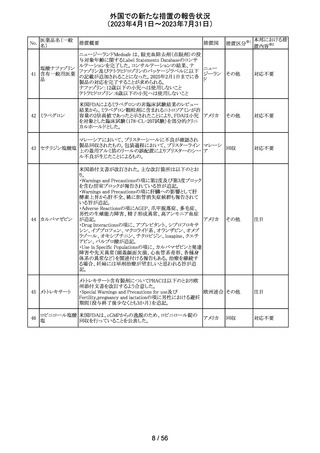
34 デスフルラン
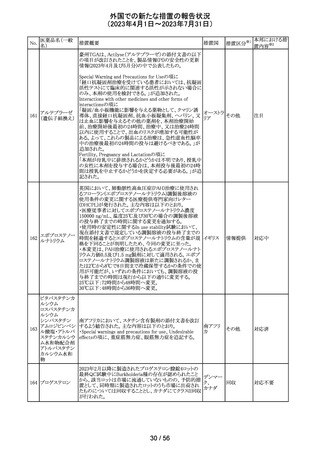
35
ポーランドは、製品に記載されている有効期限と2次元バー
ポーラン
コードを読み取り表示される有効期限が異なるため、セボフ
回収
ド
ルラン1ロットを回収したことを公表した。
ロピニロール塩酸 米国FDAは、cGMPからの逸脱のため、ロピニロール錠の
塩
回収を行っていることを公表した。
アメリカ
回収
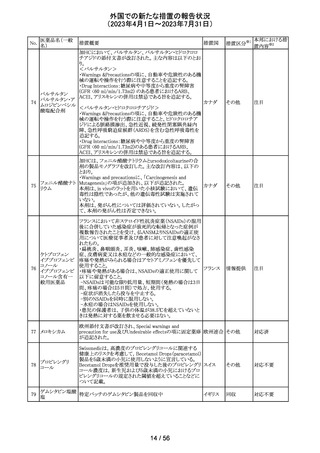
豪州TGAは、デンマークの製造所で製造された製品にお
インスリン アスパ
いて、ゴムピストンのリブ部分に薬液が混入しているペン製
ルト(遺伝子組換
品が発生しており、無菌バリアが損なわれる可能性があるこ オーストラ
36 え)
回収
とから、インスリン アスパルト(遺伝子組換え)及びセマグ リア
セマグルチド(遺
ルチド(遺伝子組換え)等の製品についてアラートを公表し
伝子組換え)
た。
6 / 56
対応不要
対応不要
注目
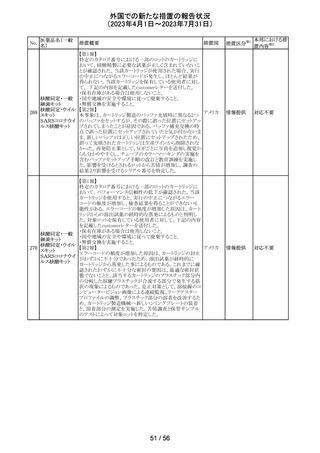
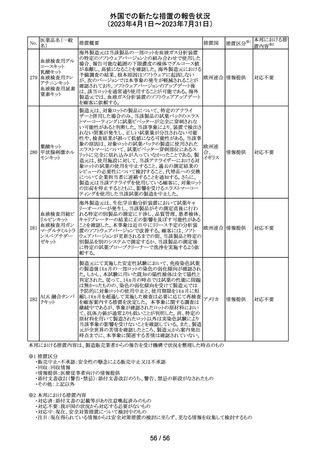
(2023年4月1日~2023年7月31日)
措置区分※1
本邦における措
置内容※2
その他
注目
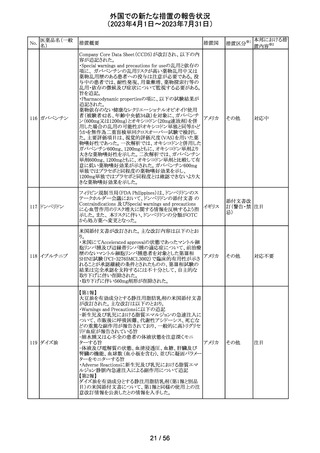
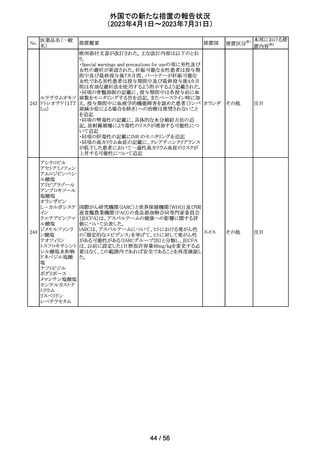
【第1報】
レルゴリクスのCCDS及び米国添付文書が改訂された。主
な変更点は以下の通り。
・Contraindicationsの項にレルゴリクス又は製品成分のいず
れかに重篤な過敏症のある患者には禁忌である旨追記。
・Warnings and PrecautionsのHypersensitivity Reactionsの
項に、レルゴリクスまたは製品成分に対して重篤な過敏症
を有する患者には禁忌である旨の追記。
・Adverse Reactionsの項に、血管浮腫を追記。
レルゴリクス
・Postmarketing Experienceの項に、血管浮腫及び蕁麻疹 オーストラ
ノルエチステロ
を含む過敏症に関する記載を追記。
リア、
33
その他
ン・エチニルエス 【第2報】
アメリカ、
トラジオール
レルゴリクス/酢酸ノルエチステロン/エストラジオールヘミ水 欧州連合
和物の欧州添付文書が改訂された。主な変更点は以下の
とおり。
Undesirable effectsの項に蕁麻疹及び血管浮腫が追記さ
れた。
【第3報】
エストラジオール/ノルエチステロン/レルゴリクスの豪州添
付文書が改訂された。主な内容は以下のとおり。
Adverse effects (undesirable effects)に、血管浮腫、蕁麻疹
が追記。
注目
No.
医薬品名(一般
名)
措置概要
措置国
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2023/2/16~2023/3/15)を入手
した。報告対象期間に入手したBNT162b2の安全性及び有
効性データから、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である。
3. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジ
メント及びファーマコヴィジランス計画で反映された重要な
リスク及び不足情報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜
炎
コロナウイルス修
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチ
飾ウリジンRNAワ
32
ン関連の呼吸器疾患増強、ギラン・バレー症候群
アメリカ
クチン(SARS-
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
CoV-2)
のある患者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、
循環器疾患、活動性結核など)、自己免疫疾患患者又は
炎症性疾患患者、他のワクチンとの相互作用、長期安全性
データ、6カ月未満の乳児、ワクチンの有効性
4. OVERVIEW OF SAFETY SIGNALS DURING THE
REPORTING INTERVAL
報告対象期間中に対処もしくは評価中であったシグナルと
して以下が記載。
月経障害(Menstrual Irregularities):Not yet determined
(Ongoing)
筋炎(Myositis):No Risk(Closed)
34 デスフルラン
35
ポーランドは、製品に記載されている有効期限と2次元バー
ポーラン
コードを読み取り表示される有効期限が異なるため、セボフ
回収
ド
ルラン1ロットを回収したことを公表した。
ロピニロール塩酸 米国FDAは、cGMPからの逸脱のため、ロピニロール錠の
塩
回収を行っていることを公表した。
アメリカ
回収
豪州TGAは、デンマークの製造所で製造された製品にお
インスリン アスパ
いて、ゴムピストンのリブ部分に薬液が混入しているペン製
ルト(遺伝子組換
品が発生しており、無菌バリアが損なわれる可能性があるこ オーストラ
36 え)
回収
とから、インスリン アスパルト(遺伝子組換え)及びセマグ リア
セマグルチド(遺
ルチド(遺伝子組換え)等の製品についてアラートを公表し
伝子組換え)
た。
6 / 56
対応不要
対応不要
注目