よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
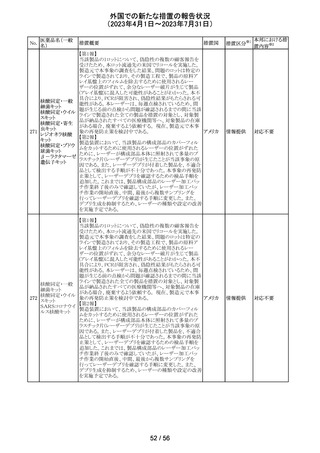
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
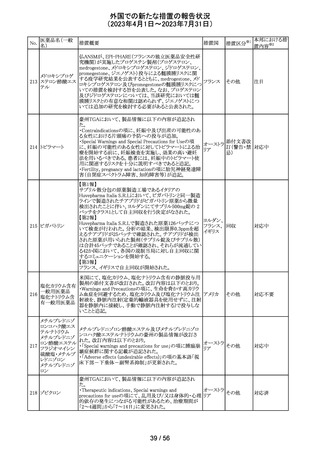
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
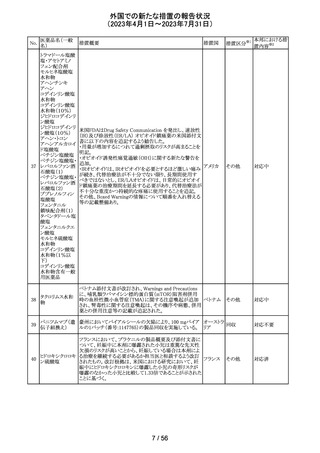
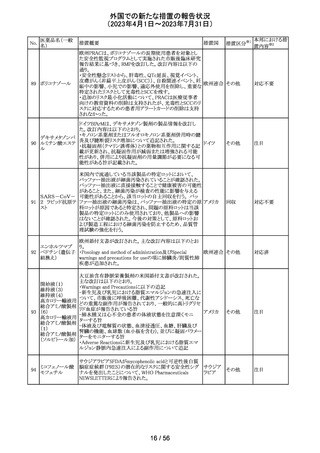
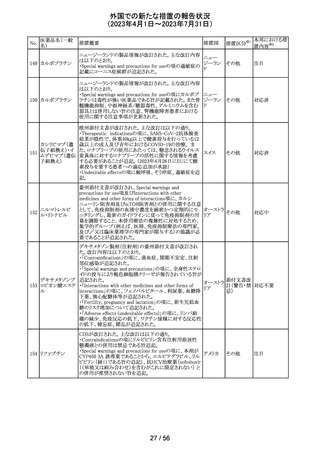
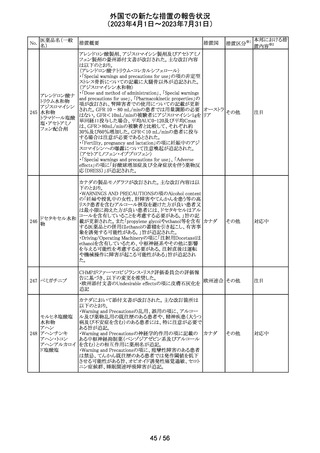
ニュージーランドMedsafe は、眼充血除去剤(点眼剤)の投
与対象年齢に関するLabel Statements Databaseのコンサ
ルテーションを完了した。コンサルテーションの結果、ナ
塩酸ナファゾリン
ニュー
ファゾリン及びテトラヒドロゾリンのパッケージラベルに以下
41 含有一般用医薬
ジーラン その他
の記載が追加されることになった。2025年2月1日までに各
品
ド
製品の対応を完了することが求められる。
ナファゾリン:12歳以下の小児へは使用しないこと
テトラヒドロゾリン:6歳以下の小児へは使用しないこと
42 ミラベグロン
米国FDAによるミラベグロンの非臨床試験結果のレビュー
結果から、ミラベグロン顆粒剤に含まれるニトロソアミンが許
容量の2倍高値であったと示されたことにより、FDAは小児 アメリカ
を対象とした臨床試験(178-CL-207試験)を部分的クリニ
カルホールドとした。
その他
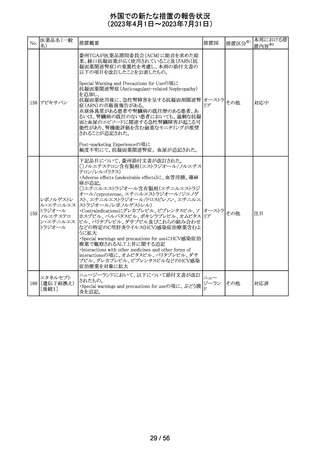
マレーシアにおいて、ブリスターシールに不良が確認され
製品回収されたもの。包装過程において、ブリスターライン マレーシ
43 セチリジン塩酸塩
回収
上の蓋用アルミ箔のリールの誤配置によりブリスターのシー ア
ル不良が生じたことによるもの。
本邦における措
置内容※2
対応不要
対応不要
対応不要
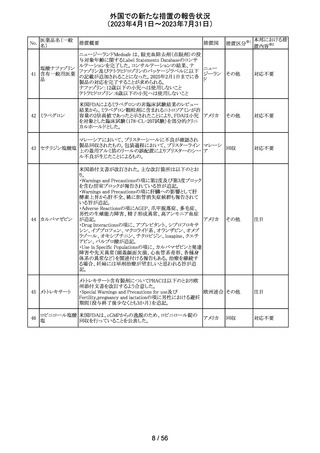
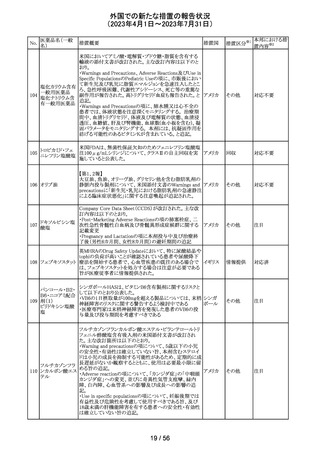
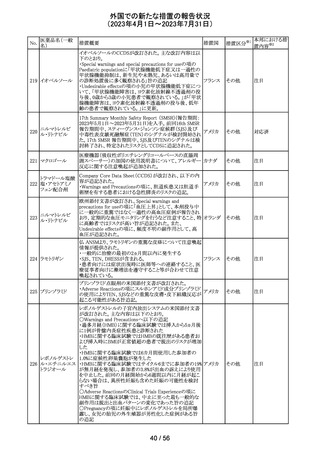
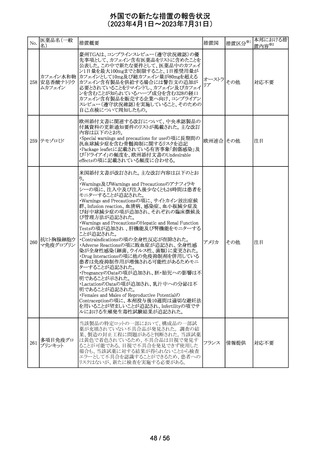
44 カルバマゼピン
米国添付文書が改訂された。主な改訂箇所は以下のとお
り。
・Warnings and Precautionsの項に第2度及び第3度ブロック
を含む房室ブロックが報告されている旨が追記。
・Warnings and Precautionsの項に肝臓への影響として肝
酵素上昇から肝不全、稀に胆管消失症候群も報告されて
いる旨が追記。
・Adverse Reactionsの項にAGEP、爪甲脱落症、多毛症、
男性の生殖能力障害、精子形成異常、高アンモニア血症
が追記。
アメリカ
・Drug Interactionsの項に、アプレピタント、シプロフロキサ
シン、イブプロフェン、マクロライド系、オランザピン、オメプ
ラゾール、オキシブチニン、チクロピジン、loxapine、クエチ
アピン、バルプロ酸が追記。
・Use in Specific Populationsの項に、カルバマゼピンと発達
障害や先天異常(頭蓋顔面欠損、心血管系奇形、各種身
体系の異常など)を関連付ける報告もある。治療を継続す
る場合、妊婦には単剤治療が望ましいと思われる旨が追
記。
その他
注目
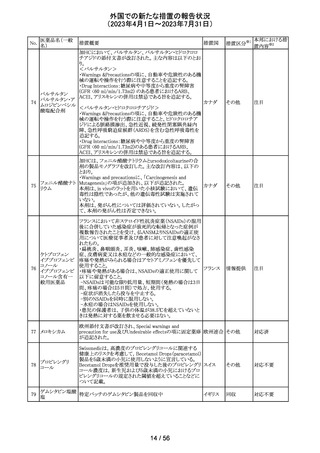
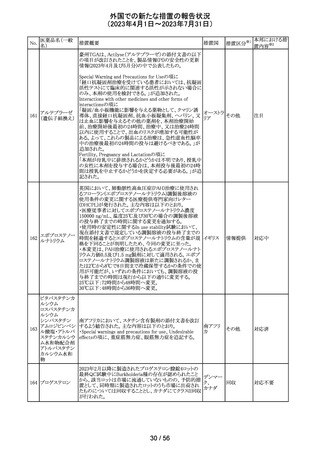
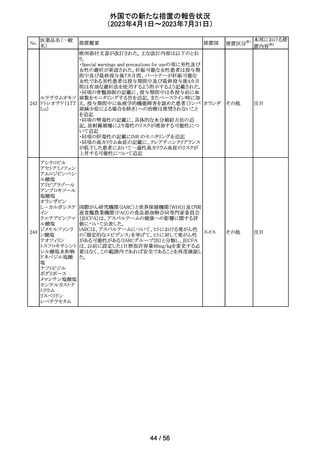
45 メトトレキサート
メトトレキサート含有製剤についてPRACは以下のとおり欧
州添付文書を改訂するよう合意した。
・Special Warnings and Precautions for use及び
欧州連合 その他
Fertility,pregnancy and lactationの項に男性における避妊
期間(投与終了後少なくとも3か月)を追記。
注目
46
ロピニロール塩酸 米国FDAは、cGMPからの逸脱のため、ロピニロール錠の
塩
回収を行っていることを公表した。
8 / 56
アメリカ
回収
対応不要
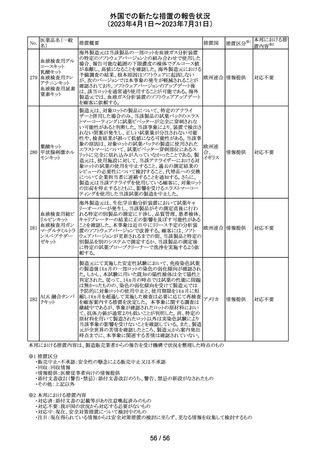
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
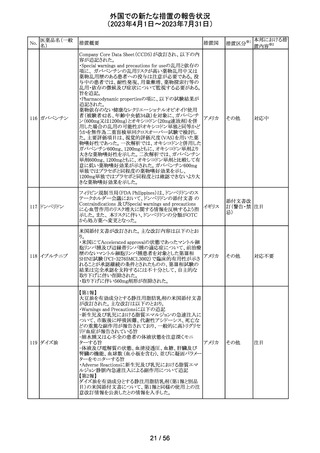
ニュージーランドMedsafe は、眼充血除去剤(点眼剤)の投
与対象年齢に関するLabel Statements Databaseのコンサ
ルテーションを完了した。コンサルテーションの結果、ナ
塩酸ナファゾリン
ニュー
ファゾリン及びテトラヒドロゾリンのパッケージラベルに以下
41 含有一般用医薬
ジーラン その他
の記載が追加されることになった。2025年2月1日までに各
品
ド
製品の対応を完了することが求められる。
ナファゾリン:12歳以下の小児へは使用しないこと
テトラヒドロゾリン:6歳以下の小児へは使用しないこと
42 ミラベグロン
米国FDAによるミラベグロンの非臨床試験結果のレビュー
結果から、ミラベグロン顆粒剤に含まれるニトロソアミンが許
容量の2倍高値であったと示されたことにより、FDAは小児 アメリカ
を対象とした臨床試験(178-CL-207試験)を部分的クリニ
カルホールドとした。
その他
マレーシアにおいて、ブリスターシールに不良が確認され
製品回収されたもの。包装過程において、ブリスターライン マレーシ
43 セチリジン塩酸塩
回収
上の蓋用アルミ箔のリールの誤配置によりブリスターのシー ア
ル不良が生じたことによるもの。
本邦における措
置内容※2
対応不要
対応不要
対応不要
44 カルバマゼピン
米国添付文書が改訂された。主な改訂箇所は以下のとお
り。
・Warnings and Precautionsの項に第2度及び第3度ブロック
を含む房室ブロックが報告されている旨が追記。
・Warnings and Precautionsの項に肝臓への影響として肝
酵素上昇から肝不全、稀に胆管消失症候群も報告されて
いる旨が追記。
・Adverse Reactionsの項にAGEP、爪甲脱落症、多毛症、
男性の生殖能力障害、精子形成異常、高アンモニア血症
が追記。
アメリカ
・Drug Interactionsの項に、アプレピタント、シプロフロキサ
シン、イブプロフェン、マクロライド系、オランザピン、オメプ
ラゾール、オキシブチニン、チクロピジン、loxapine、クエチ
アピン、バルプロ酸が追記。
・Use in Specific Populationsの項に、カルバマゼピンと発達
障害や先天異常(頭蓋顔面欠損、心血管系奇形、各種身
体系の異常など)を関連付ける報告もある。治療を継続す
る場合、妊婦には単剤治療が望ましいと思われる旨が追
記。
その他
注目
45 メトトレキサート
メトトレキサート含有製剤についてPRACは以下のとおり欧
州添付文書を改訂するよう合意した。
・Special Warnings and Precautions for use及び
欧州連合 その他
Fertility,pregnancy and lactationの項に男性における避妊
期間(投与終了後少なくとも3か月)を追記。
注目
46
ロピニロール塩酸 米国FDAは、cGMPからの逸脱のため、ロピニロール錠の
塩
回収を行っていることを公表した。
8 / 56
アメリカ
回収
対応不要