よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
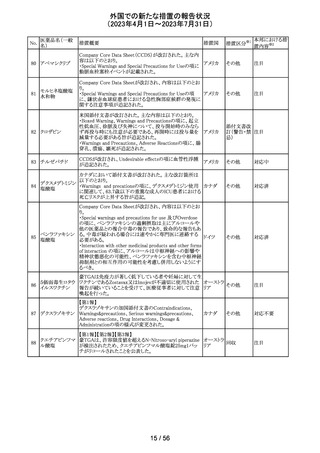
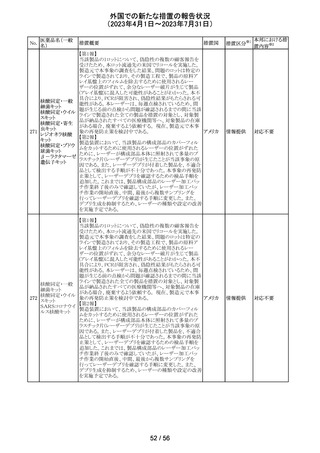
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
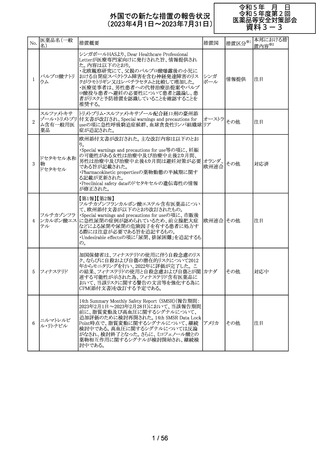
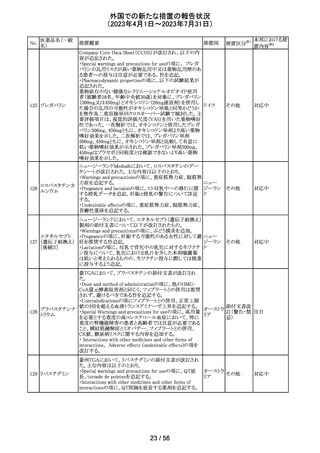
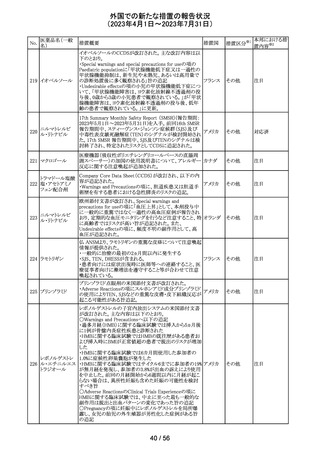
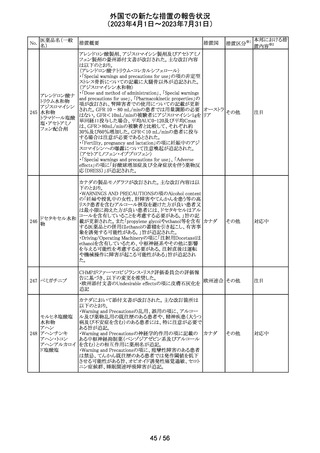
欧州PRACの公表された議事録において、妊娠の可能性
のある女性におけるバルプロ酸を含む医薬品の薬物利用
についての研究が報告された。内容は以下のとおり。
・ベルギー、フィンランド、ドイツ、オランダ、スペイン、英国
の欧州6か国のデータベースにおいて、12~55歳の女性を
バルプロ酸ナトリ 対象としたバルプロ酸含有医薬品の使用状況を適応症、
99
欧州連合 その他
ウム
暦年、年齢ごとに層別化し特徴を明らかにするもの。
・バルプロ酸の使用率が2010年から2021年の間に減少し、
かつ45歳未満の患者の使用率は45歳以上の患者と比較し
て低くなった。
・PRACはこの研究の結果、直ちに規制措置を講じる必要
はないとの報告者意見に同意した。
対応不要
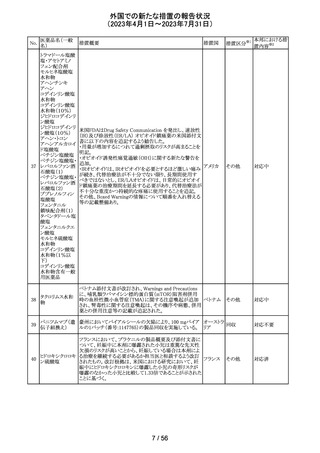
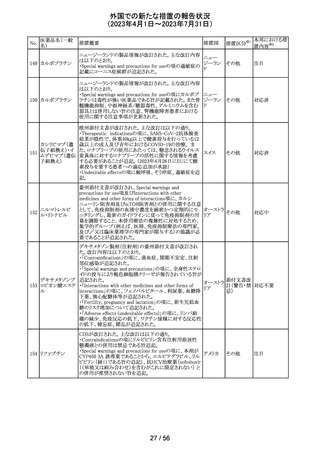
米国添付文書が改訂され、以下の内容が追記、変更され
た。
・Drug Interactions の項に黄体ホルモン単剤の避妊薬が
追記され、経口避妊薬が避妊薬に修正された。
100 トピラマート
アメリカ
その他
対応済
米国添付文書が改訂された。主な内容は以下のとおり。
・Warnings and Precautionsの Increased Risk of Bleedingの
項に抗血小板薬が追記、またワルファリンを服用している
患者ではINRを注意深く監視することと追記。
・全般性不安障害における7歳~17歳の小児への対象拡
エスシタロプラム
101
大が承認されたことに伴い、Adverse ReactionsのClinical アメリカ
シュウ酸塩
Trials Experienceの項及びUse in Specific Populationsの項
が改訂された。成人試験で認められた副作用プロファイル
と概ね同様であったとの事で、プラセボより高い発生率か
つ2%以上の事象として、めまい、鼻咽頭炎、腹部不快感、
不安、イライラ、怒りがあげられている。
その他
注目
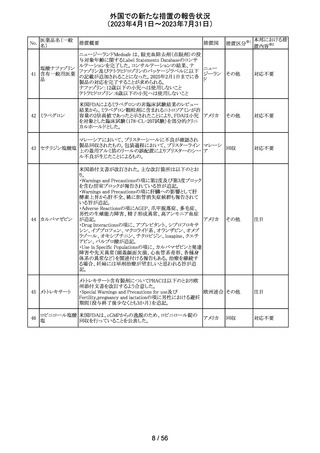
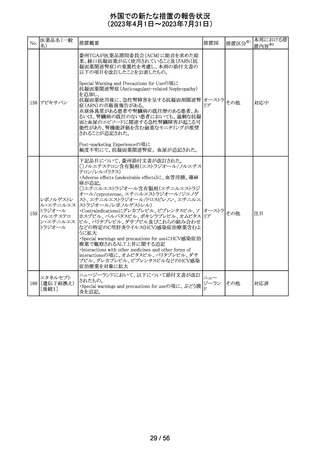
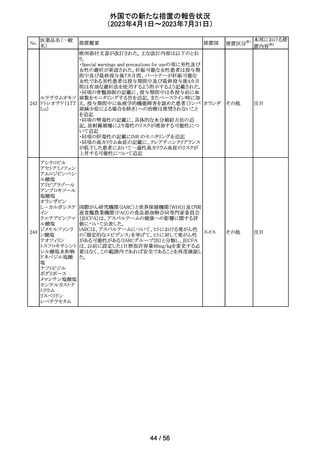
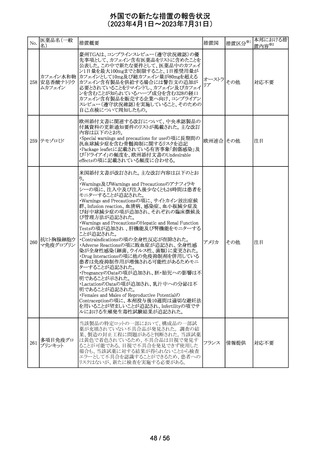
筋肉注射用製剤のカナダ添付文書が改訂され、Serious
Warnings & Precautionsの項に以下の内容が記載された。
ベンジルペニシリ ・不注意の静脈内投与による心肺停止や死亡例の報告が
102 ンベンザチン水 あり、また神経内又は神経付近への投与で永久的な神経 カナダ
和物
障害を引き起こす可能性がる。
・ペニシリンを含むβ-ラクタム系抗菌薬で、致命的な過敏
症、重篤な皮膚有害反応が報告されている。
その他
対応済
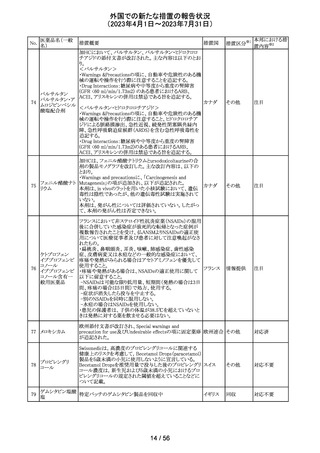
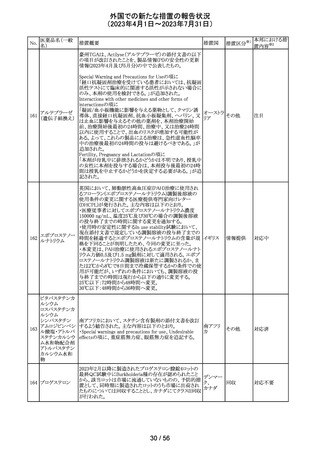
エジプトPharmacovigilance Center (EPVC)は、医療従事者
に対し、セファロスポリン系の薬剤(セフトリアキソンとセフォ
タキシムを含む)の投与前に実施すべき、重度の過敏反
応、アナフィラキシー、その他の生命を脅かす有害事象の
リスクを最小化するための安全対策として Direct
Healthcare Professional Communication(DHPC)を発行し
た。主な内容は下記の通り。
セフトリアキソンナ
103
・昨今、セフォタキシム及びセフトリアキソンの不適切な投 エジプト
トリウム水和物
与、又は皮内反応テストを行わずに投与したことに関連す
る可能性のある過敏症、アナフィラキシー及び生命を脅か
す有害事象の報告を受けている。
・投与前に本剤及び他のセファロスポリン、又は他の種類
のベータラクタム系薬剤に対する過敏症反応の病歴の有
無を確認すること。
・皮内テストを行うこと。
情報提供
対応不要
18 / 56
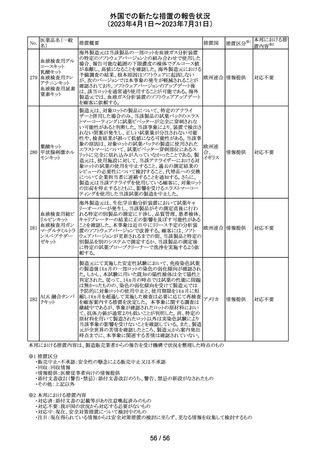
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
欧州PRACの公表された議事録において、妊娠の可能性
のある女性におけるバルプロ酸を含む医薬品の薬物利用
についての研究が報告された。内容は以下のとおり。
・ベルギー、フィンランド、ドイツ、オランダ、スペイン、英国
の欧州6か国のデータベースにおいて、12~55歳の女性を
バルプロ酸ナトリ 対象としたバルプロ酸含有医薬品の使用状況を適応症、
99
欧州連合 その他
ウム
暦年、年齢ごとに層別化し特徴を明らかにするもの。
・バルプロ酸の使用率が2010年から2021年の間に減少し、
かつ45歳未満の患者の使用率は45歳以上の患者と比較し
て低くなった。
・PRACはこの研究の結果、直ちに規制措置を講じる必要
はないとの報告者意見に同意した。
対応不要
米国添付文書が改訂され、以下の内容が追記、変更され
た。
・Drug Interactions の項に黄体ホルモン単剤の避妊薬が
追記され、経口避妊薬が避妊薬に修正された。
100 トピラマート
アメリカ
その他
対応済
米国添付文書が改訂された。主な内容は以下のとおり。
・Warnings and Precautionsの Increased Risk of Bleedingの
項に抗血小板薬が追記、またワルファリンを服用している
患者ではINRを注意深く監視することと追記。
・全般性不安障害における7歳~17歳の小児への対象拡
エスシタロプラム
101
大が承認されたことに伴い、Adverse ReactionsのClinical アメリカ
シュウ酸塩
Trials Experienceの項及びUse in Specific Populationsの項
が改訂された。成人試験で認められた副作用プロファイル
と概ね同様であったとの事で、プラセボより高い発生率か
つ2%以上の事象として、めまい、鼻咽頭炎、腹部不快感、
不安、イライラ、怒りがあげられている。
その他
注目
筋肉注射用製剤のカナダ添付文書が改訂され、Serious
Warnings & Precautionsの項に以下の内容が記載された。
ベンジルペニシリ ・不注意の静脈内投与による心肺停止や死亡例の報告が
102 ンベンザチン水 あり、また神経内又は神経付近への投与で永久的な神経 カナダ
和物
障害を引き起こす可能性がる。
・ペニシリンを含むβ-ラクタム系抗菌薬で、致命的な過敏
症、重篤な皮膚有害反応が報告されている。
その他
対応済
エジプトPharmacovigilance Center (EPVC)は、医療従事者
に対し、セファロスポリン系の薬剤(セフトリアキソンとセフォ
タキシムを含む)の投与前に実施すべき、重度の過敏反
応、アナフィラキシー、その他の生命を脅かす有害事象の
リスクを最小化するための安全対策として Direct
Healthcare Professional Communication(DHPC)を発行し
た。主な内容は下記の通り。
セフトリアキソンナ
103
・昨今、セフォタキシム及びセフトリアキソンの不適切な投 エジプト
トリウム水和物
与、又は皮内反応テストを行わずに投与したことに関連す
る可能性のある過敏症、アナフィラキシー及び生命を脅か
す有害事象の報告を受けている。
・投与前に本剤及び他のセファロスポリン、又は他の種類
のベータラクタム系薬剤に対する過敏症反応の病歴の有
無を確認すること。
・皮内テストを行うこと。
情報提供
対応不要
18 / 56