よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
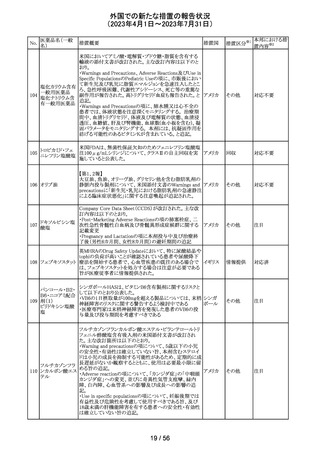
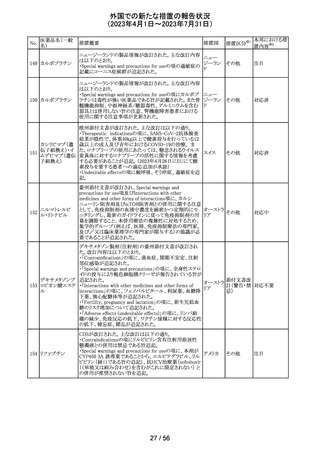
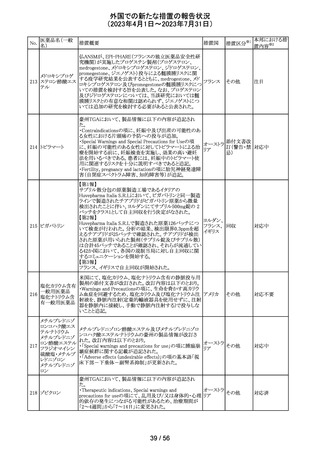
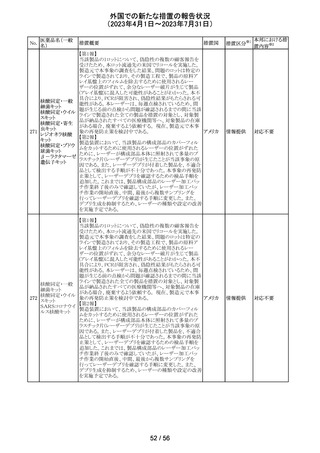
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
医薬品名(一般
名)
措置概要
7
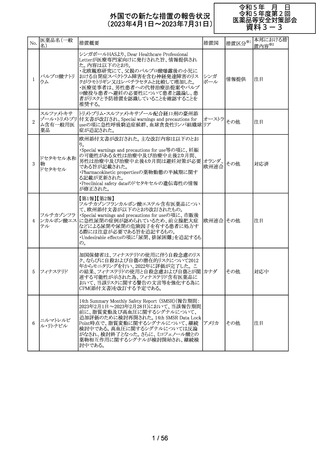
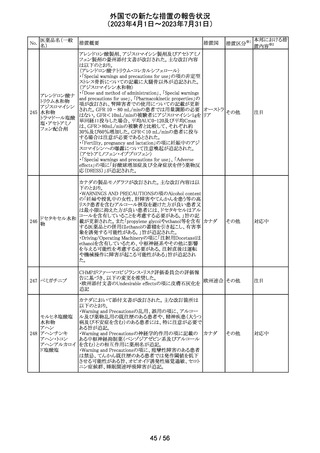
ロミデプシン
加HCがウェブサイトにて、以下の情報を公表した。
・ロミデプシンは、移植不適応で、少なくとも一回の全身療
法歴がある再発/難治性末梢性T細胞リンパ腫(PTCL)患
者の治療のための条件遵守通知の下で承認された。
・初発PTCLを対象とした第3相検証試験において、化学療
法とロミデプシン併用投与群が化学療法単独投与群よりも
カナダ
PTCLの進行を遅延させる効果が高いことを示すことができ
なかった。そのため、現在ロミデプシンを使用している患者
の治療が完了し次第、ロミデプシンはカナダ市場から撤退
することから、新しい患者では開始しないよう勧告された。
・ただし、ロミデプシン単剤療法に新たな安全性の問題は
認められていない。
8
モルヒネ塩酸塩
米国FDAは、過量投与防止の一環としてopioid鎮痛剤破棄
水和物
のための返送用封筒を使用可能とすることを検討している アメリカ
ブプレノルフィン
と公表した。
塩酸塩
No.
9
エトポシド
10 ロラゼパム
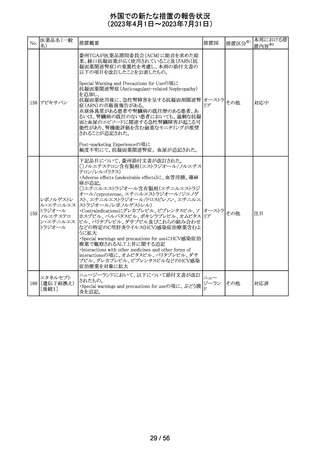
措置国
措置区分※1
本邦における措
置内容※2
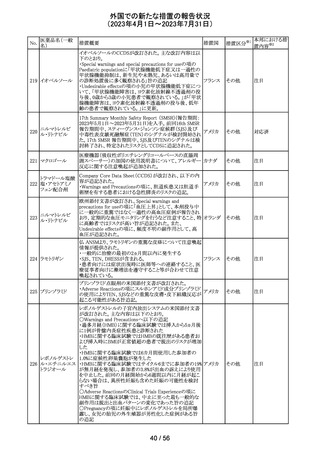
情報提供
対応不要
その他
対応不要
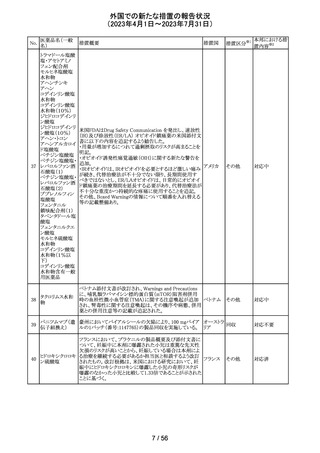
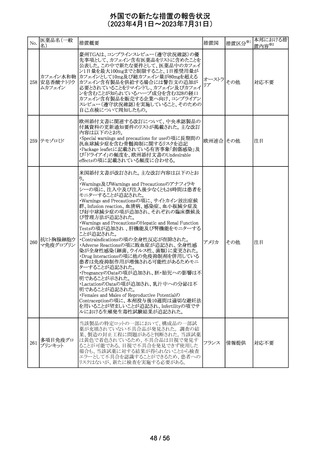
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・SPECIAL WARNINGS AND PRECAUTIONS FOR USEの
項に他の抗悪性腫瘍薬との併用患者における二次性白血
病、腫瘍崩壊症候群及びパラオキシ安息香酸エステルに
よるアレルギー反応が追記された。
オーストラ
その他
・INTERACTIONS WITH OTHER MEDICINES AND
リア
OTHER FORMS OF INTERACTIONSの項に同様の骨髄
抑制効果を有する薬剤との併用における骨髄抑制が記載
された。
・ADVERSE EFFECTS (UNDESIRABLE EFFECTS)の項に
骨髄抑制が記載された。
注目
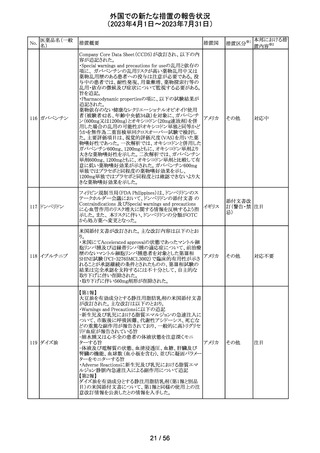
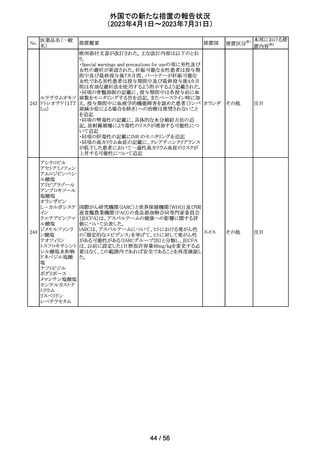
注射剤の米国添付文書が改訂された。主な改訂箇所は以
下のとおり。
・Warnings及びPrecautionsの項に、妊娠後期にロラゼパム
を使用すると、新生児の鎮静(呼吸抑制、嗜眠、筋緊張低
下)、離脱症状を引き起こす可能性がある旨が追記された。
・Precautionsの項に、ロラゼパムは母乳中に移行する。鎮
静の報告がある。母乳を介してベンゾジアゼピンに曝露さ
アメリカ
れた乳児の摂食不良、体重増加不良の報告がある旨が追
記された。
・Overdoseの項に、他の中枢神経抑制薬(アルコールやオ
ピオイドを含む)と組み合わせた過剰摂取の場合致命的な
可能性がある旨、過剰摂取時のフルマゼニルの投与は離
脱や発作等を引き起こす可能性があり、特にてんかん重積
状態の患者では禁忌である旨が追記された。
対応中
その他
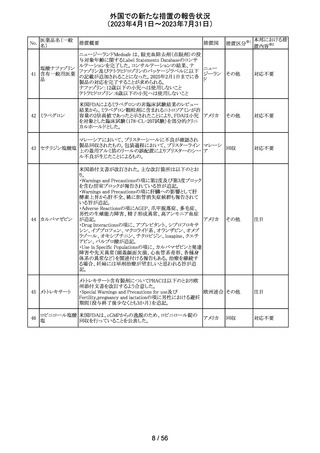
エチニルエストラジオール/gestodene、エチニルエストラジ
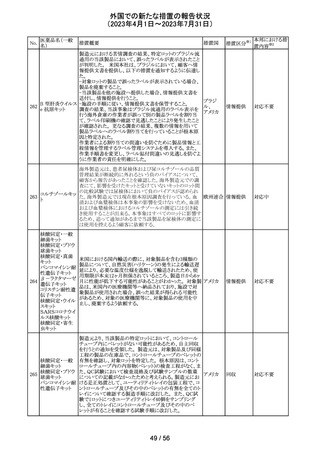
オール/レボノルゲストレル、エチニルエストラジオール/ノ
レボノルゲストレ
ルエチステロンの豪州添付文書が改訂された。
ル・エチニルエス
主な改訂の内容は以下のとおり。
トラジオール
オーストラ
11
Contraindications、Special warnings and precautions for
その他
ノルエチステロ
リア
use、Interactions with other medicines and other forms of
ン・エチニルエス
interactionsの項において、ALT上昇のリスクにより併用を
トラジオール
禁忌とするHCV治療薬としてグレカプレビル、ピブレンタス
ビルとの併用が追記された。
注目
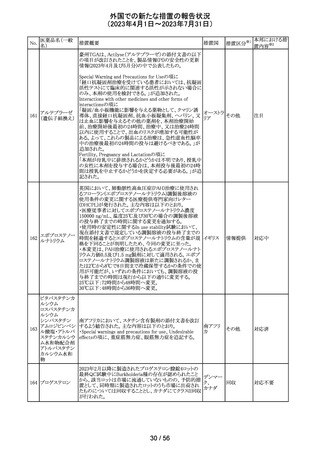
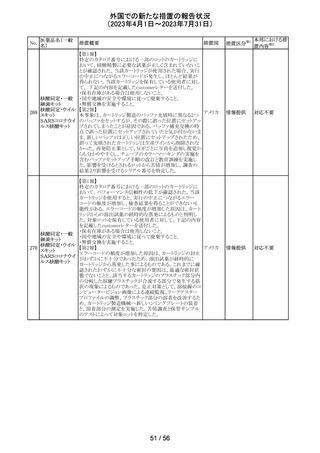
米国添付文書改訂に伴い、CCDSが改訂された。
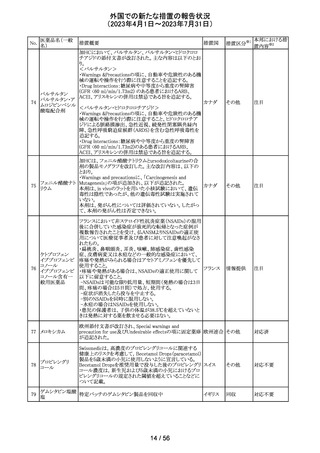
ヨード化ケシ油脂
・Contraindicationsの項に 「子宮卵管造影時、腫瘍の腹膜
12 肪酸エチルエス
フランス
播種を引き起こす可能性があるため、生殖器に腫瘍のある
テル
患者への使用を禁忌とする」旨の追記
注目
2 / 56
その他
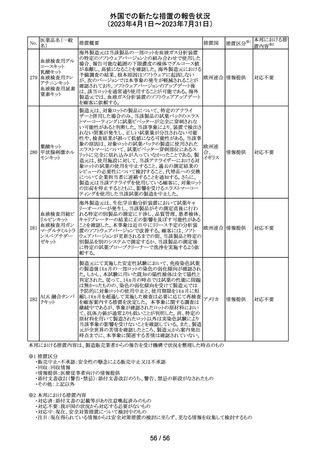
(2023年4月1日~2023年7月31日)
医薬品名(一般
名)
措置概要
7
ロミデプシン
加HCがウェブサイトにて、以下の情報を公表した。
・ロミデプシンは、移植不適応で、少なくとも一回の全身療
法歴がある再発/難治性末梢性T細胞リンパ腫(PTCL)患
者の治療のための条件遵守通知の下で承認された。
・初発PTCLを対象とした第3相検証試験において、化学療
法とロミデプシン併用投与群が化学療法単独投与群よりも
カナダ
PTCLの進行を遅延させる効果が高いことを示すことができ
なかった。そのため、現在ロミデプシンを使用している患者
の治療が完了し次第、ロミデプシンはカナダ市場から撤退
することから、新しい患者では開始しないよう勧告された。
・ただし、ロミデプシン単剤療法に新たな安全性の問題は
認められていない。
8
モルヒネ塩酸塩
米国FDAは、過量投与防止の一環としてopioid鎮痛剤破棄
水和物
のための返送用封筒を使用可能とすることを検討している アメリカ
ブプレノルフィン
と公表した。
塩酸塩
No.
9
エトポシド
10 ロラゼパム
措置国
措置区分※1
本邦における措
置内容※2
情報提供
対応不要
その他
対応不要
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・SPECIAL WARNINGS AND PRECAUTIONS FOR USEの
項に他の抗悪性腫瘍薬との併用患者における二次性白血
病、腫瘍崩壊症候群及びパラオキシ安息香酸エステルに
よるアレルギー反応が追記された。
オーストラ
その他
・INTERACTIONS WITH OTHER MEDICINES AND
リア
OTHER FORMS OF INTERACTIONSの項に同様の骨髄
抑制効果を有する薬剤との併用における骨髄抑制が記載
された。
・ADVERSE EFFECTS (UNDESIRABLE EFFECTS)の項に
骨髄抑制が記載された。
注目
注射剤の米国添付文書が改訂された。主な改訂箇所は以
下のとおり。
・Warnings及びPrecautionsの項に、妊娠後期にロラゼパム
を使用すると、新生児の鎮静(呼吸抑制、嗜眠、筋緊張低
下)、離脱症状を引き起こす可能性がある旨が追記された。
・Precautionsの項に、ロラゼパムは母乳中に移行する。鎮
静の報告がある。母乳を介してベンゾジアゼピンに曝露さ
アメリカ
れた乳児の摂食不良、体重増加不良の報告がある旨が追
記された。
・Overdoseの項に、他の中枢神経抑制薬(アルコールやオ
ピオイドを含む)と組み合わせた過剰摂取の場合致命的な
可能性がある旨、過剰摂取時のフルマゼニルの投与は離
脱や発作等を引き起こす可能性があり、特にてんかん重積
状態の患者では禁忌である旨が追記された。
対応中
その他
エチニルエストラジオール/gestodene、エチニルエストラジ
オール/レボノルゲストレル、エチニルエストラジオール/ノ
レボノルゲストレ
ルエチステロンの豪州添付文書が改訂された。
ル・エチニルエス
主な改訂の内容は以下のとおり。
トラジオール
オーストラ
11
Contraindications、Special warnings and precautions for
その他
ノルエチステロ
リア
use、Interactions with other medicines and other forms of
ン・エチニルエス
interactionsの項において、ALT上昇のリスクにより併用を
トラジオール
禁忌とするHCV治療薬としてグレカプレビル、ピブレンタス
ビルとの併用が追記された。
注目
米国添付文書改訂に伴い、CCDSが改訂された。
ヨード化ケシ油脂
・Contraindicationsの項に 「子宮卵管造影時、腫瘍の腹膜
12 肪酸エチルエス
フランス
播種を引き起こす可能性があるため、生殖器に腫瘍のある
テル
患者への使用を禁忌とする」旨の追記
注目
2 / 56
その他