よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
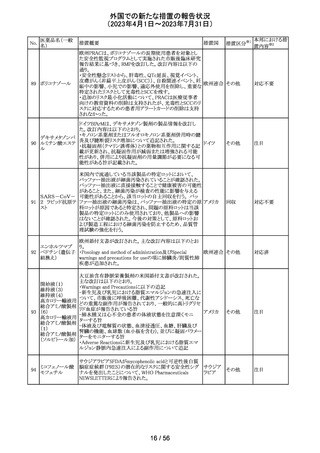
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
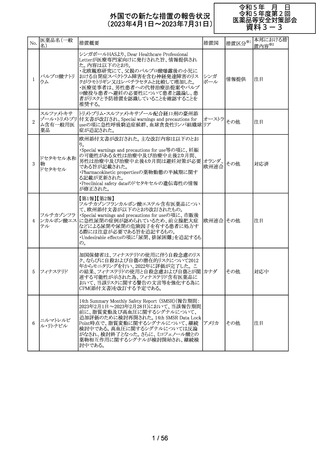
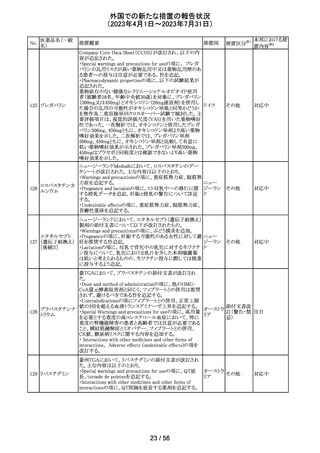
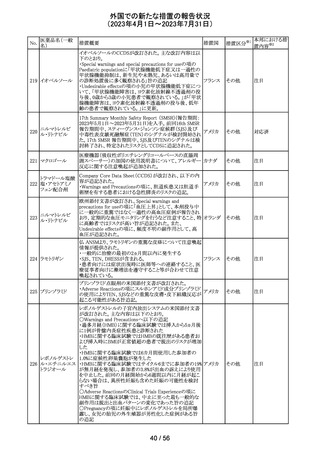
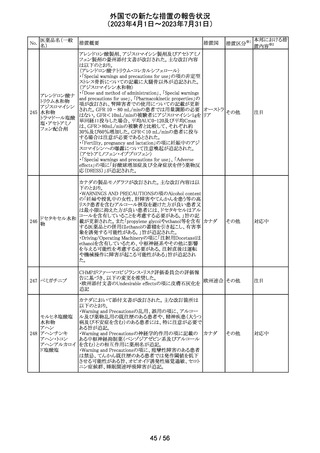
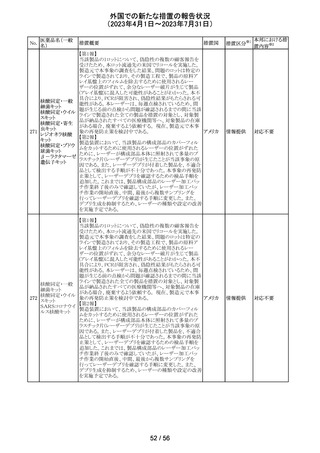
豪州TGAは、Actilyse(アルテプラーゼ)の添付文書の以下
の項目が改訂されたことを、製品情報(PI)の安全性の更新
情報(2023年4月及び5月分)の中で公表したもの。
Special Warning and Precautions for Useの項に
「経口抗凝固剤治療を受けている患者においては、抗凝固
活性テストにて臨床的に関連する活性が示されない場合に
のみ、本剤の使用を検討できる。」が追加された。
Interactions with other medicines and other forms of
interactionsの項に
「凝固/血小板機能に影響を与える薬物として、クマリン誘
アルテプラーゼ
オーストラ
161
導体、直接経口抗凝固剤、抗血小板凝集剤、ヘパリン、又
その他
(遺伝子組換え)
リア
は止血に影響を与えるその他の薬剤を、本剤治療開始
前、治療開始後最初の24時間、治療中、又は治療24時間
以内に使用することで、出血のリスクが増加する可能性が
ある。よって、これらの製品による治療は、急性虚血性脳卒
中の治療後最初の24時間の投与は避けるべきである。」が
追加された。
Fertility, Pregnancy and Lactationの項に
「本剤が母乳中に排泄されるかどうかは不明であり、授乳中
の女性に本剤を投与する場合は、本剤投与後最初の24時
間は授乳を中止するかどうかを決定する必要がある。」が追
記された。
注目
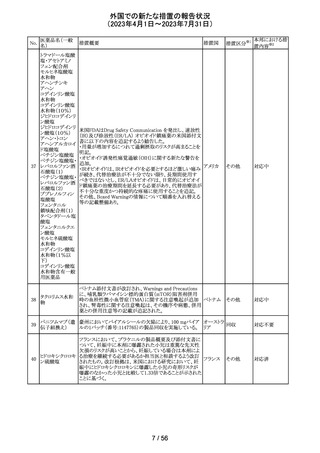
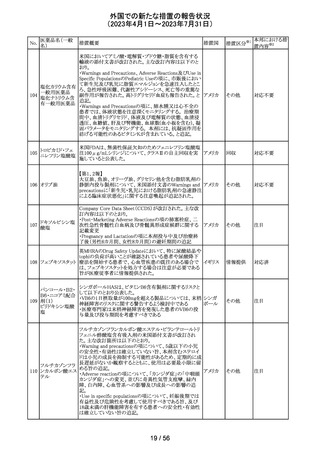
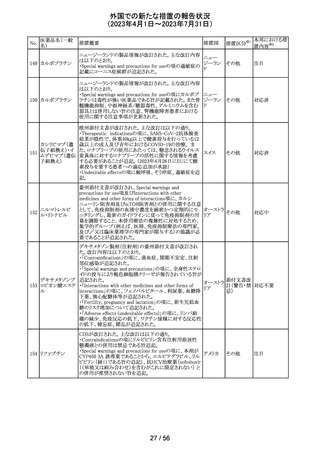
英国において、肺動脈性高血圧症(PAH)治療に使用され
るフローラン(エポプロステノールナトリウム)調製後溶液の
使用条件の変更に関する医療提供専門家向けレター
(DHCPL)が発行された。主な内容は以下のとおり。
・医療従事者に対してエポプロステノールナトリウム濃度
150000 ng/mL、温度25℃及び30℃の場合の調製後溶液
の投与終了までの時間に関する変更を通知する。
・使用時の安定性に関するIn use stability試験において、
現在添付文書で規定している調製溶液の投与終了までの
エポプロステノー
162
時間を経過するとエポプロステノールナトリウムの含量が規 イギリス
ルナトリウム
格を下回ることが判明したため、今回の変更に至った。
・本変更は、PAH治療に使用されるエポプロステノールナト
リウム力価0.5及び1.5 mg製剤に対して適用される。エポプ
ロステノールナトリウム調製溶液は新たに調製されるか、ま
たは2℃から8℃で8日間まで冷蔵保管するかの条件での使
用が可能だが、いずれの条件においても、調製溶液の投
与終了までの時間は現行から以下の通りに変更する。
25℃以下:72時間から48時間へ変更。
30℃以下:48時間から36時間へ変更。
情報提供
対応中
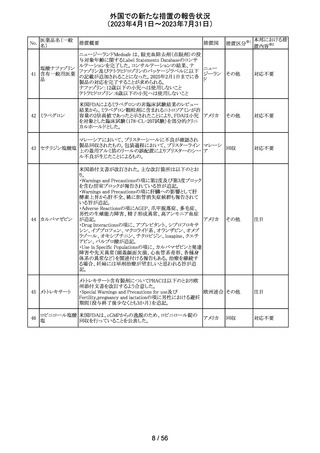
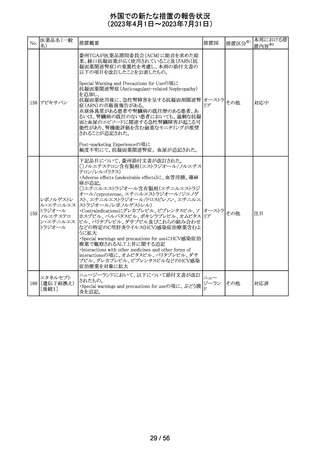
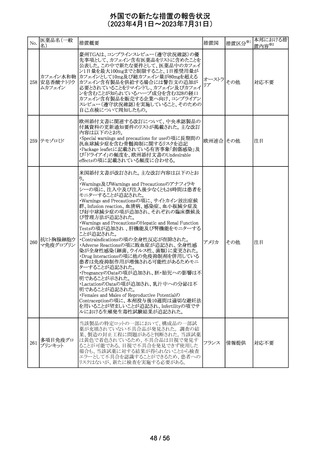
ピタバスタチンカ
ルシウム
ロスバスタチンカ
ルシウム
シンバスタチン
南アフリカにおいて、スタチン含有製剤の添付文書を改訂
アムロジピンベシ するよう勧告された。主な内容は以下のとおり。
南アフリ
163
ル酸塩・アトルバ ・Special warnings and precautions for use、Undesirable
カ
スタチンカルシウ effectsの項に、重症筋無力症、眼筋無力症を追記する。
ム水和物配合剤
アトルバスタチン
カルシウム水和
物
その他
対応済
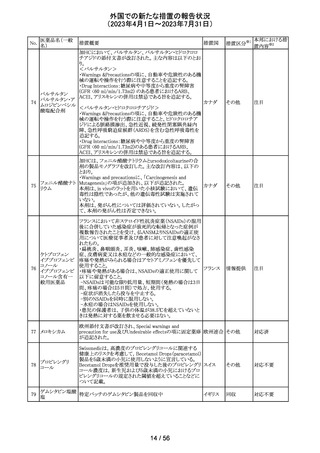
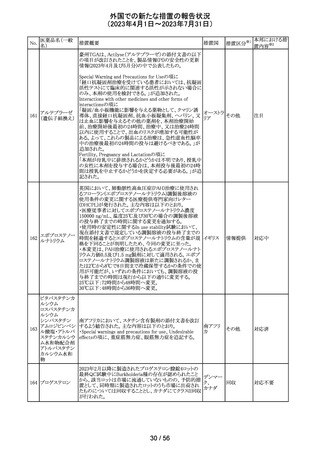
164 プロゲステロン
2023年2月以降に製造されたプロゲステロン膣錠4ロットの
最終QC試験中にBurkholderia種の存在が認められたこと
デンマー
から、該当ロットは市場に流通していないものの、予防的措
ク、
回収
置として、同時期に製造されたロットのうち市場に出荷され
カナダ
たものについては回収することとし、カナダにてクラスII回収
が行われた。
30 / 56
対応不要
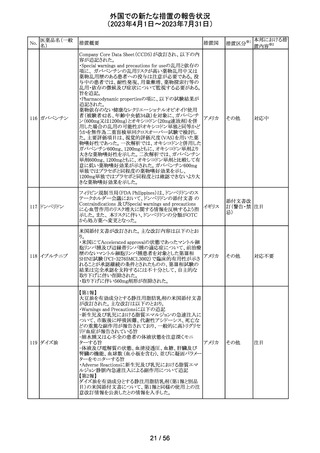
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
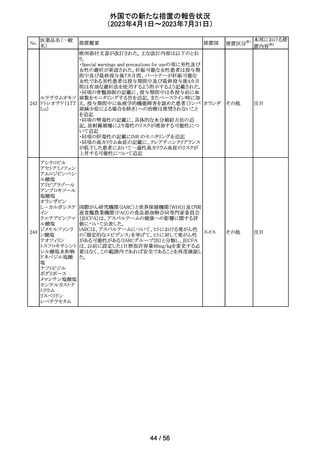
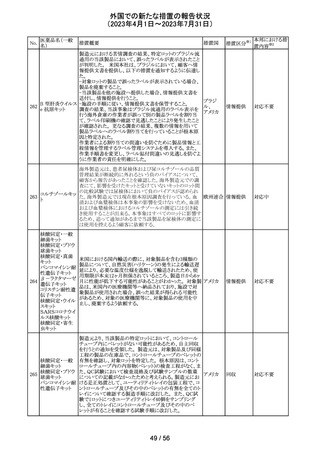
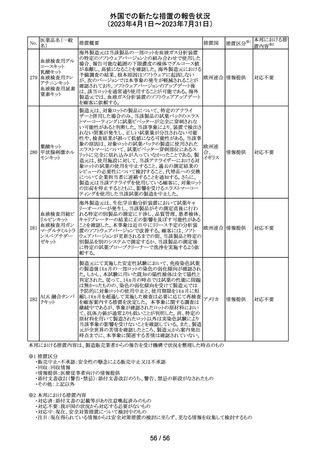
豪州TGAは、Actilyse(アルテプラーゼ)の添付文書の以下
の項目が改訂されたことを、製品情報(PI)の安全性の更新
情報(2023年4月及び5月分)の中で公表したもの。
Special Warning and Precautions for Useの項に
「経口抗凝固剤治療を受けている患者においては、抗凝固
活性テストにて臨床的に関連する活性が示されない場合に
のみ、本剤の使用を検討できる。」が追加された。
Interactions with other medicines and other forms of
interactionsの項に
「凝固/血小板機能に影響を与える薬物として、クマリン誘
アルテプラーゼ
オーストラ
161
導体、直接経口抗凝固剤、抗血小板凝集剤、ヘパリン、又
その他
(遺伝子組換え)
リア
は止血に影響を与えるその他の薬剤を、本剤治療開始
前、治療開始後最初の24時間、治療中、又は治療24時間
以内に使用することで、出血のリスクが増加する可能性が
ある。よって、これらの製品による治療は、急性虚血性脳卒
中の治療後最初の24時間の投与は避けるべきである。」が
追加された。
Fertility, Pregnancy and Lactationの項に
「本剤が母乳中に排泄されるかどうかは不明であり、授乳中
の女性に本剤を投与する場合は、本剤投与後最初の24時
間は授乳を中止するかどうかを決定する必要がある。」が追
記された。
注目
英国において、肺動脈性高血圧症(PAH)治療に使用され
るフローラン(エポプロステノールナトリウム)調製後溶液の
使用条件の変更に関する医療提供専門家向けレター
(DHCPL)が発行された。主な内容は以下のとおり。
・医療従事者に対してエポプロステノールナトリウム濃度
150000 ng/mL、温度25℃及び30℃の場合の調製後溶液
の投与終了までの時間に関する変更を通知する。
・使用時の安定性に関するIn use stability試験において、
現在添付文書で規定している調製溶液の投与終了までの
エポプロステノー
162
時間を経過するとエポプロステノールナトリウムの含量が規 イギリス
ルナトリウム
格を下回ることが判明したため、今回の変更に至った。
・本変更は、PAH治療に使用されるエポプロステノールナト
リウム力価0.5及び1.5 mg製剤に対して適用される。エポプ
ロステノールナトリウム調製溶液は新たに調製されるか、ま
たは2℃から8℃で8日間まで冷蔵保管するかの条件での使
用が可能だが、いずれの条件においても、調製溶液の投
与終了までの時間は現行から以下の通りに変更する。
25℃以下:72時間から48時間へ変更。
30℃以下:48時間から36時間へ変更。
情報提供
対応中
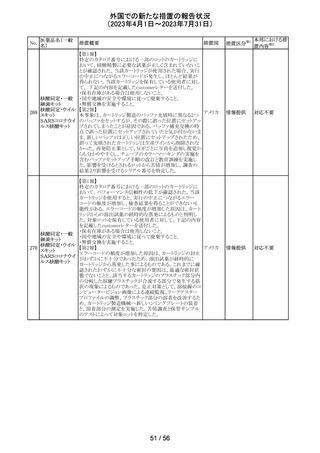
ピタバスタチンカ
ルシウム
ロスバスタチンカ
ルシウム
シンバスタチン
南アフリカにおいて、スタチン含有製剤の添付文書を改訂
アムロジピンベシ するよう勧告された。主な内容は以下のとおり。
南アフリ
163
ル酸塩・アトルバ ・Special warnings and precautions for use、Undesirable
カ
スタチンカルシウ effectsの項に、重症筋無力症、眼筋無力症を追記する。
ム水和物配合剤
アトルバスタチン
カルシウム水和
物
その他
対応済
164 プロゲステロン
2023年2月以降に製造されたプロゲステロン膣錠4ロットの
最終QC試験中にBurkholderia種の存在が認められたこと
デンマー
から、該当ロットは市場に流通していないものの、予防的措
ク、
回収
置として、同時期に製造されたロットのうち市場に出荷され
カナダ
たものについては回収することとし、カナダにてクラスII回収
が行われた。
30 / 56
対応不要