よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
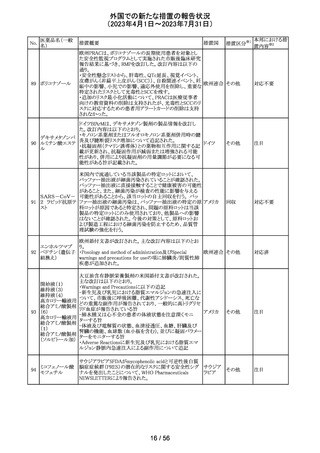
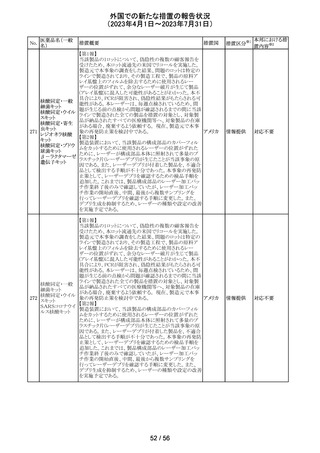
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
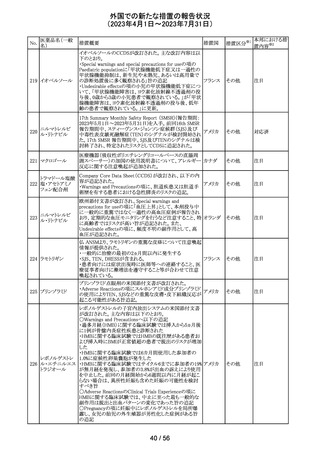
措置区分※1
本邦における措
置内容※2
情報提供
注目
回収
対応不要
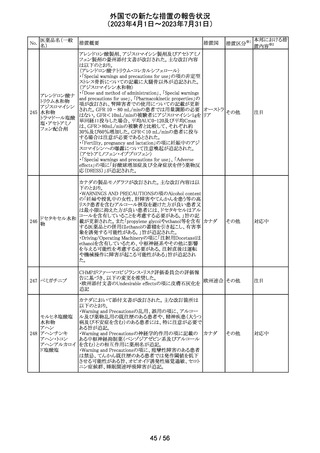
報告企業がGlobal本社からCompany Core Data Sheet
(CCDS)を入手し、Contraindications及びSpecial warnings
and precautions for useの項に、以下の内容が記載されて
いたため、報告された。
Contraindicationsの項
・活性物質またはいずれかの賦形剤に対する過敏症
Special warnings and precautions for useの項
・治療が長期にわたる小児患者においては、成長遅延のリ
スクに注意すること。
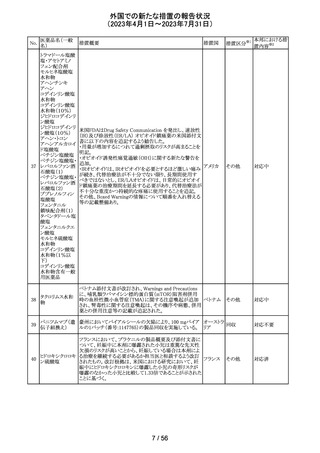
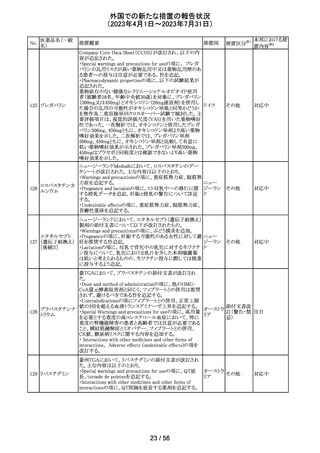
ベクロメタゾンプロ
205
・ステロイド剤を併用投与した場合(特に全身投与)に、全 ドイツ
ピオン酸エステル
身作用、副腎皮質機能抑制、成長遅延のリスクが増加する
こと。
・減量は徐々に、綿密な医学的管理のもとで減量を続けな
ければならないこと。
・鼻を手術した患者や鼻に外傷がある患者には、治癒が完
了するまで、鼻からの局所投与は推奨されないこと。
・肺結核患者への投与に際しては注意が必要であること。
・ベンザルコニウム塩化物が含まれており、長期使用により
鼻粘膜の浮腫を引き起こす可能性があること。
その他
注目
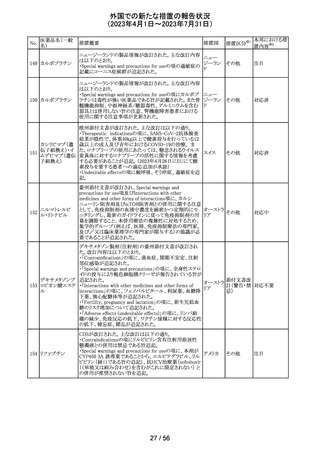
英国MHRAは2022年の研究データからNSAIDsの妊娠20週
以降の長期使用後の羊水過少、胎児腎障害、動脈管早期
ジクロフェナクナト 閉鎖の潜在的な発現リスクについて注意喚起し、イブプロ
206
イギリス
リウム
フェン、ナプロキセン、ジクロフェナクなどの全身(経口およ
び注射)NSAIDの使用は、妊娠末期、(妊娠28週以降)には
禁忌であることのリマインドを行った。
その他
注目
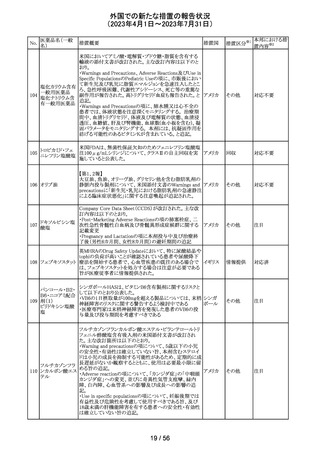
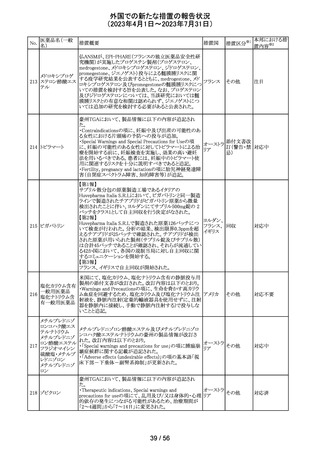
No.
医薬品名(一般
名)
措置概要
措置国
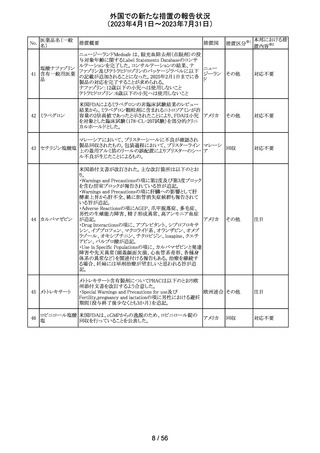
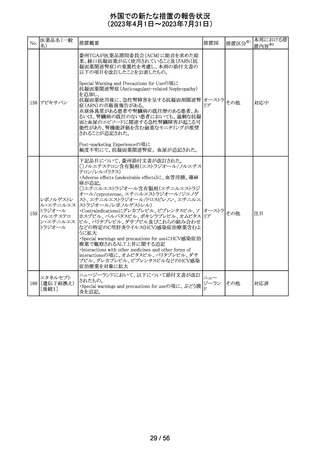
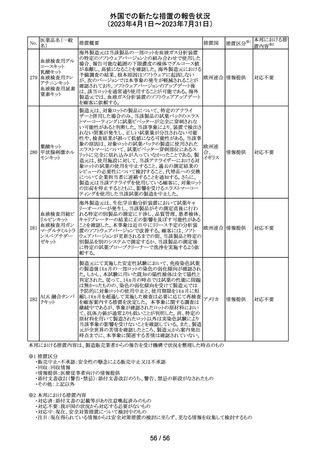
仏ANSMからクロミフェンクエン酸塩について、医療関係者
に対してDirect healthcare professional communications
(DHPC)が発出され、以下が注意喚起された。
・かすみ目、視力の低下、光視、及び閃輝暗点(斑点また
は閃光)等の視覚障害は、既知のリスクである。
・クロミフェンの使用により、視神経炎、虚血性視神経障
害、網膜中心静脈閉塞、網膜剥離、硝子体剥離等の新た
な視覚の有害事象が報告されており、クロミフェンの中止
後、特に投与量や治療期間を増加した場合、場合によって
クロミフェンクエン
203
は視覚障害(失明)を引き起こす。
フランス
酸塩
・治療の開始時に、患者にはそのリスクについて警告し、視
覚障害が現れた場合は直ちに治療を中止し、医師に知ら
せるべきであると警告する必要がある。
・患者に視覚異常の症状が認められた場合は精密な眼科
検査が必要であり、他の原因が認められなければクロミフェ
ンの投与を恒久的に中止するべきである。
・過去又は現在の治療経過においてクロミフェンの使用に
よる重要な視覚症状が確定診断されている患者について
は、クロミフェンの使用は禁忌とされた。
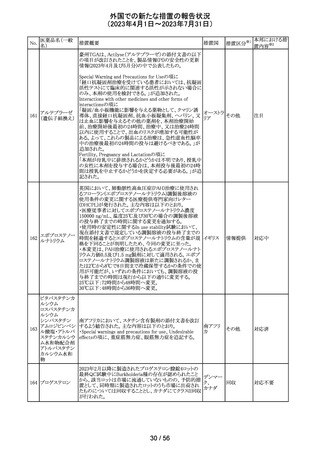
204 トラネキサム酸
米国FDAは機関誌のEnforcement Report 2023年6月21日
号において、 トラネキサム酸製剤の一部の米国製販企業
において、規格に適合しない製品が確認されたことから、
アメリカ
以下のロットにおいて、Class III の自主回収が行われたこ
とが報告された。(ロット番号:X220317A、X220318A、使用
期限 : 2025年9月)
37 / 56
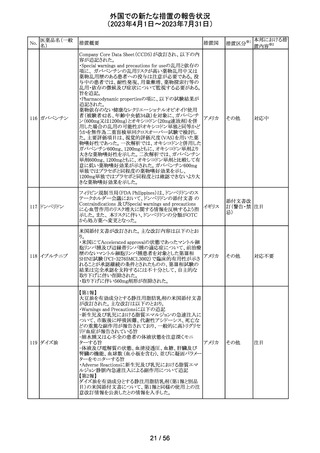
(2023年4月1日~2023年7月31日)
措置区分※1
本邦における措
置内容※2
情報提供
注目
回収
対応不要
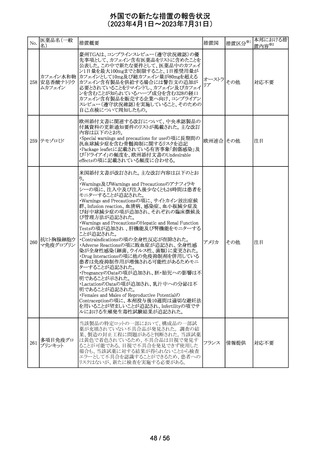
報告企業がGlobal本社からCompany Core Data Sheet
(CCDS)を入手し、Contraindications及びSpecial warnings
and precautions for useの項に、以下の内容が記載されて
いたため、報告された。
Contraindicationsの項
・活性物質またはいずれかの賦形剤に対する過敏症
Special warnings and precautions for useの項
・治療が長期にわたる小児患者においては、成長遅延のリ
スクに注意すること。
ベクロメタゾンプロ
205
・ステロイド剤を併用投与した場合(特に全身投与)に、全 ドイツ
ピオン酸エステル
身作用、副腎皮質機能抑制、成長遅延のリスクが増加する
こと。
・減量は徐々に、綿密な医学的管理のもとで減量を続けな
ければならないこと。
・鼻を手術した患者や鼻に外傷がある患者には、治癒が完
了するまで、鼻からの局所投与は推奨されないこと。
・肺結核患者への投与に際しては注意が必要であること。
・ベンザルコニウム塩化物が含まれており、長期使用により
鼻粘膜の浮腫を引き起こす可能性があること。
その他
注目
英国MHRAは2022年の研究データからNSAIDsの妊娠20週
以降の長期使用後の羊水過少、胎児腎障害、動脈管早期
ジクロフェナクナト 閉鎖の潜在的な発現リスクについて注意喚起し、イブプロ
206
イギリス
リウム
フェン、ナプロキセン、ジクロフェナクなどの全身(経口およ
び注射)NSAIDの使用は、妊娠末期、(妊娠28週以降)には
禁忌であることのリマインドを行った。
その他
注目
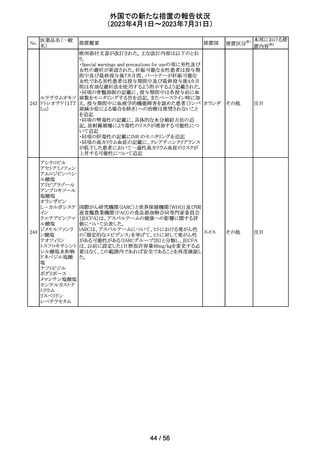
No.
医薬品名(一般
名)
措置概要
措置国
仏ANSMからクロミフェンクエン酸塩について、医療関係者
に対してDirect healthcare professional communications
(DHPC)が発出され、以下が注意喚起された。
・かすみ目、視力の低下、光視、及び閃輝暗点(斑点また
は閃光)等の視覚障害は、既知のリスクである。
・クロミフェンの使用により、視神経炎、虚血性視神経障
害、網膜中心静脈閉塞、網膜剥離、硝子体剥離等の新た
な視覚の有害事象が報告されており、クロミフェンの中止
後、特に投与量や治療期間を増加した場合、場合によって
クロミフェンクエン
203
は視覚障害(失明)を引き起こす。
フランス
酸塩
・治療の開始時に、患者にはそのリスクについて警告し、視
覚障害が現れた場合は直ちに治療を中止し、医師に知ら
せるべきであると警告する必要がある。
・患者に視覚異常の症状が認められた場合は精密な眼科
検査が必要であり、他の原因が認められなければクロミフェ
ンの投与を恒久的に中止するべきである。
・過去又は現在の治療経過においてクロミフェンの使用に
よる重要な視覚症状が確定診断されている患者について
は、クロミフェンの使用は禁忌とされた。
204 トラネキサム酸
米国FDAは機関誌のEnforcement Report 2023年6月21日
号において、 トラネキサム酸製剤の一部の米国製販企業
において、規格に適合しない製品が確認されたことから、
アメリカ
以下のロットにおいて、Class III の自主回収が行われたこ
とが報告された。(ロット番号:X220317A、X220318A、使用
期限 : 2025年9月)
37 / 56