よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
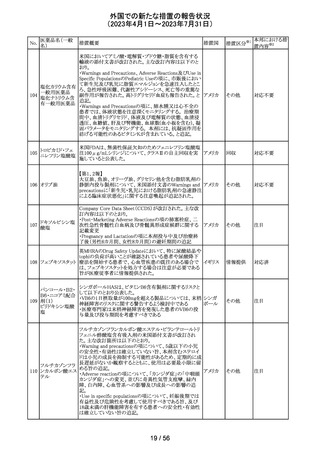
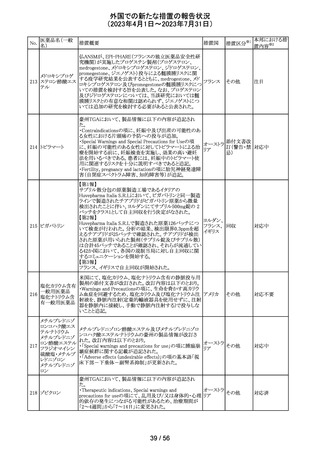
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
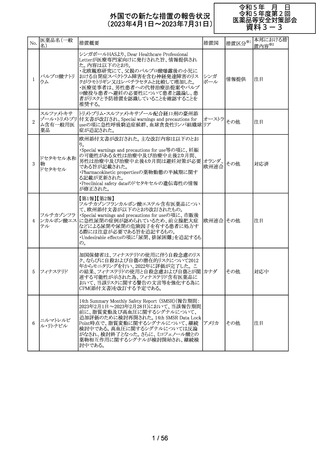
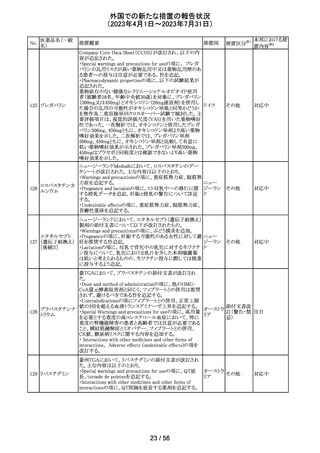
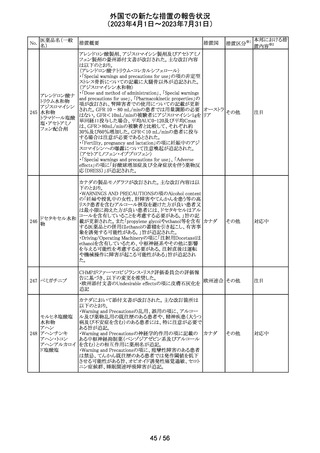
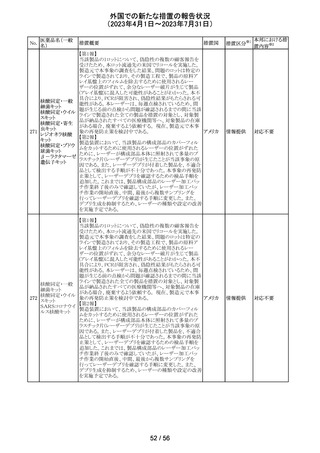
89 ボリコナゾール
措置概要
措置国
措置区分※1
欧州PRACは、ボリコナゾールの長期使用患者を対象とし
た安全性監視プログラムとして実施された市販後臨床研究
報告結果に基づき、RMPを改訂した。改訂内容は以下の
通り。
・安全性懸念リストから、肝毒性、QTc延長、視覚イベント、
皮膚がん(非扁平上皮がん(SCC))、自殺関連イベント、妊
欧州連合 その他
娠中の影響、小児での影響、適応外使用を削除し、重要な
特定されたリスクとして光毒性とSCCを残す。
・追加のリスク最小化活動について、PRACは医療従事者
向けの教育資料の削除は支持されたが、光毒性とSCCのリ
スクに対応するための患者用アラートカードの削除は支持
されなかった。
本邦における措
置内容※2
対応不要
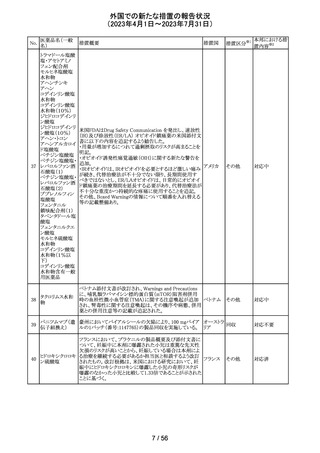
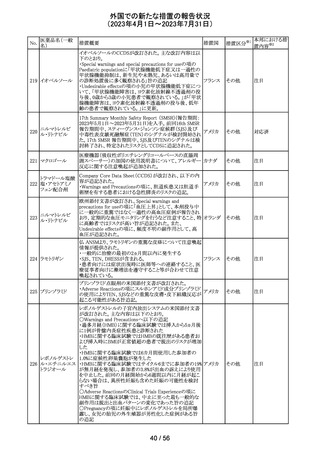
ドイツBfArMは、デキサメタゾン製剤の製品情報を改訂し
た。改訂内容は以下のとおり。
・キノロン系薬剤またはフルオロキノロン系薬剤併用時の腱
デキサメタゾンパ
炎及び腱断裂リスク増加について追記された。
90 ルミチン酸エステ
ドイツ
・抗凝固剤(クマリン誘導体)との薬物相互作用に関する記
ル
載が更新され、抗凝固作用が減弱または増強される可能
性があり、併用により抗凝固剤の用量調節が必要になる可
能性がある旨が記載された。
その他
注目
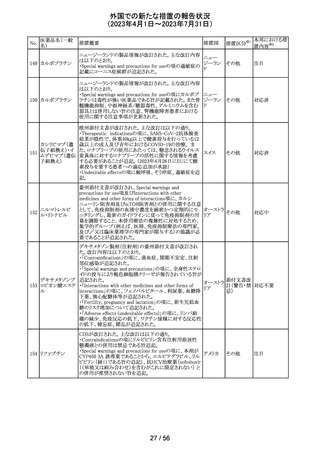
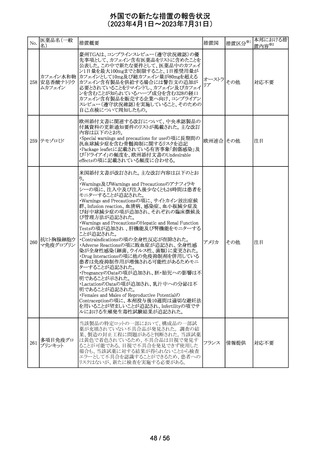
米国内で流通している当該製品の特定ロットにおいて、
バッファー抽出液が細菌汚染されていることが確認された。
バッファー抽出液に直接接触することで健康被害の可能性
があること、また、細菌汚染が検査の性能に影響を与える
SARS-CoV- 可能性があることから、該当ロットの自主回収を行う。 バッ
91 2 ラピッド抗原テ ファー抽出液の細菌汚染は、バッファー抽出液の特定の原 アメリカ
スト
料ロットが原因であると特定され、問題の原料ロットは当該
製品の特定ロットにのみ使用されており、他製品への影響
はないことが確認された。今後の対策として、原料ロットお
よび製造工程における細菌汚染を防止するため、品質管
理試験の強化を行う。
回収
対応不要
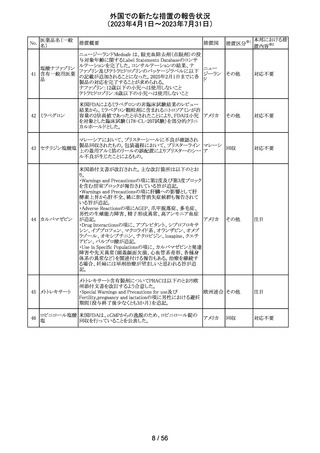
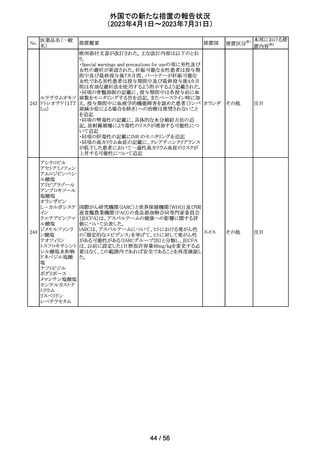
欧州添付文書が改訂された。主な改訂内容は以下のとお
エンホルツマブ り。
92 ベドチン(遺伝子 ・Posology and method of administration及びSpecial
欧州連合 その他
組換え)
warnings and precautions for useの項に肺臓炎/間質性肺
疾患が追加された。
対応済
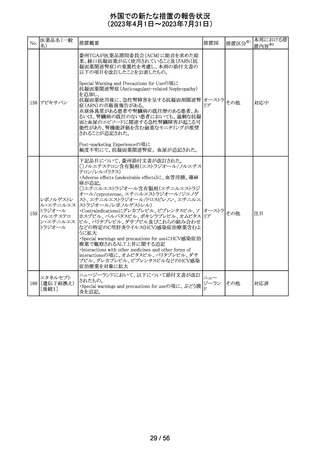
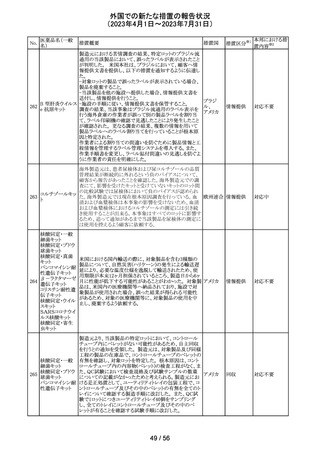
大豆油含有静脈栄養製剤の米国添付文書が改訂された。
主な改訂は以下のとおり。
開始液(1)
・Warnings and Precautionsに以下の追記
維持液(3)
-新生児及び乳児における脂質エマルジョンの急速注入に
維持液(4)
ついて、市販後に呼吸困難、代謝性アシドーシス、死亡な
高カロリー輸液用
どの重篤な副作用が報告されており、一般的に高トリグリセ
総合アミノ酸製剤
リド血症が報告されている旨
93 (6)
アメリカ
-肺水腫又は心不全の患者の体液状態を注意深くモニ
高カロリー輸液用
ターする旨
総合アミノ酸製剤
-体液及び電解質の状態、血清浸透圧、血糖、肝臓及び
(1)
腎臓の機能、血球数 (血小板を含む)、並びに凝固パラメー
総合アミノ酸製剤
ターをモニターする旨
(ソルビトール加)
・Adverse Reactionsに新生児及び乳児における脂質エマ
ルジョン静脈内急速注入による副作用について追記
その他
注目
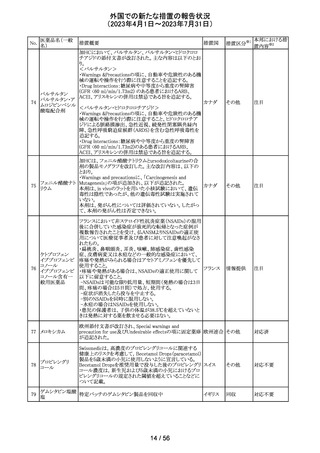
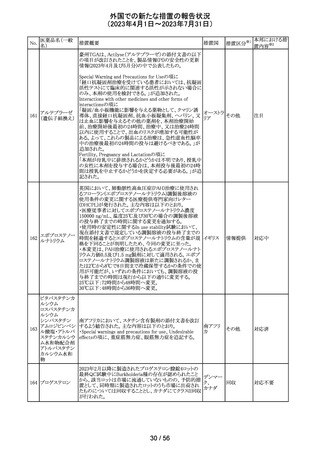
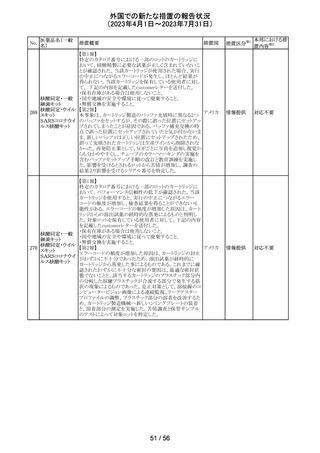
サウジアラビアSFDAがmycophenolic acidと可逆性後白質
ミコフェノール酸 脳症症候群(PRES)の潜在的なリスクに関する安全性シグ サウジア
94
その他
モフェチル
ナルを発出したことについて、WHO Pharmaceuticals
ラビア
NEWSLETTERにより報告された。
注目
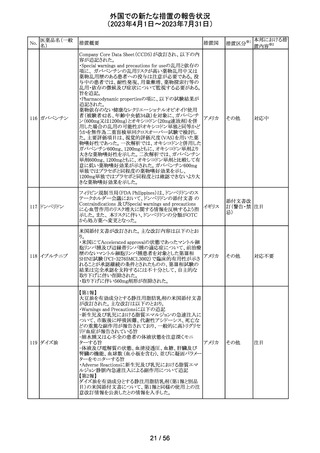
16 / 56
(2023年4月1日~2023年7月31日)
No.
医薬品名(一般
名)
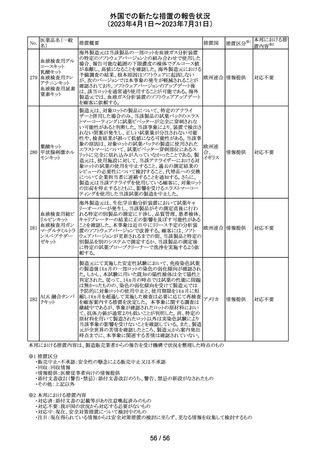
89 ボリコナゾール
措置概要
措置国
措置区分※1
欧州PRACは、ボリコナゾールの長期使用患者を対象とし
た安全性監視プログラムとして実施された市販後臨床研究
報告結果に基づき、RMPを改訂した。改訂内容は以下の
通り。
・安全性懸念リストから、肝毒性、QTc延長、視覚イベント、
皮膚がん(非扁平上皮がん(SCC))、自殺関連イベント、妊
欧州連合 その他
娠中の影響、小児での影響、適応外使用を削除し、重要な
特定されたリスクとして光毒性とSCCを残す。
・追加のリスク最小化活動について、PRACは医療従事者
向けの教育資料の削除は支持されたが、光毒性とSCCのリ
スクに対応するための患者用アラートカードの削除は支持
されなかった。
本邦における措
置内容※2
対応不要
ドイツBfArMは、デキサメタゾン製剤の製品情報を改訂し
た。改訂内容は以下のとおり。
・キノロン系薬剤またはフルオロキノロン系薬剤併用時の腱
デキサメタゾンパ
炎及び腱断裂リスク増加について追記された。
90 ルミチン酸エステ
ドイツ
・抗凝固剤(クマリン誘導体)との薬物相互作用に関する記
ル
載が更新され、抗凝固作用が減弱または増強される可能
性があり、併用により抗凝固剤の用量調節が必要になる可
能性がある旨が記載された。
その他
注目
米国内で流通している当該製品の特定ロットにおいて、
バッファー抽出液が細菌汚染されていることが確認された。
バッファー抽出液に直接接触することで健康被害の可能性
があること、また、細菌汚染が検査の性能に影響を与える
SARS-CoV- 可能性があることから、該当ロットの自主回収を行う。 バッ
91 2 ラピッド抗原テ ファー抽出液の細菌汚染は、バッファー抽出液の特定の原 アメリカ
スト
料ロットが原因であると特定され、問題の原料ロットは当該
製品の特定ロットにのみ使用されており、他製品への影響
はないことが確認された。今後の対策として、原料ロットお
よび製造工程における細菌汚染を防止するため、品質管
理試験の強化を行う。
回収
対応不要
欧州添付文書が改訂された。主な改訂内容は以下のとお
エンホルツマブ り。
92 ベドチン(遺伝子 ・Posology and method of administration及びSpecial
欧州連合 その他
組換え)
warnings and precautions for useの項に肺臓炎/間質性肺
疾患が追加された。
対応済
大豆油含有静脈栄養製剤の米国添付文書が改訂された。
主な改訂は以下のとおり。
開始液(1)
・Warnings and Precautionsに以下の追記
維持液(3)
-新生児及び乳児における脂質エマルジョンの急速注入に
維持液(4)
ついて、市販後に呼吸困難、代謝性アシドーシス、死亡な
高カロリー輸液用
どの重篤な副作用が報告されており、一般的に高トリグリセ
総合アミノ酸製剤
リド血症が報告されている旨
93 (6)
アメリカ
-肺水腫又は心不全の患者の体液状態を注意深くモニ
高カロリー輸液用
ターする旨
総合アミノ酸製剤
-体液及び電解質の状態、血清浸透圧、血糖、肝臓及び
(1)
腎臓の機能、血球数 (血小板を含む)、並びに凝固パラメー
総合アミノ酸製剤
ターをモニターする旨
(ソルビトール加)
・Adverse Reactionsに新生児及び乳児における脂質エマ
ルジョン静脈内急速注入による副作用について追記
その他
注目
サウジアラビアSFDAがmycophenolic acidと可逆性後白質
ミコフェノール酸 脳症症候群(PRES)の潜在的なリスクに関する安全性シグ サウジア
94
その他
モフェチル
ナルを発出したことについて、WHO Pharmaceuticals
ラビア
NEWSLETTERにより報告された。
注目
16 / 56