よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況[1.3MB] (42 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36611.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和5年度第2回 11/30)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
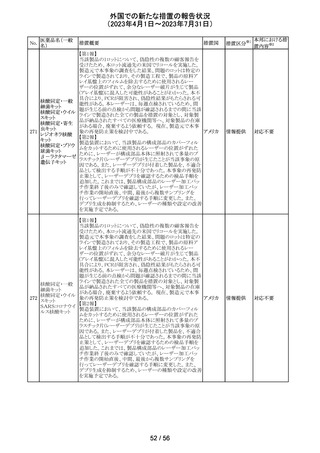
外国での新たな措置の報告状況
(2023年4月1日~2023年7月31日)
措置区分※1
本邦における措
置内容※2
その他
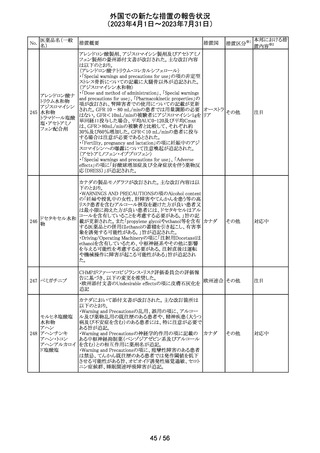
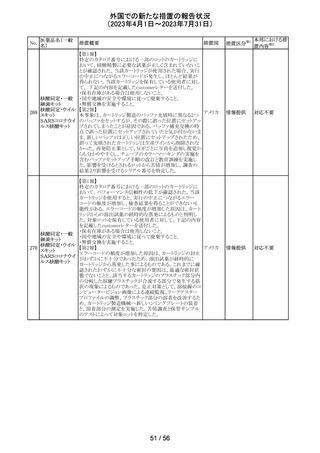
注目
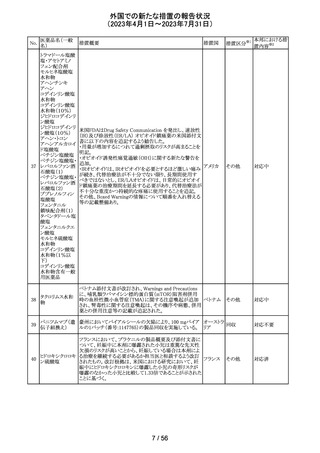
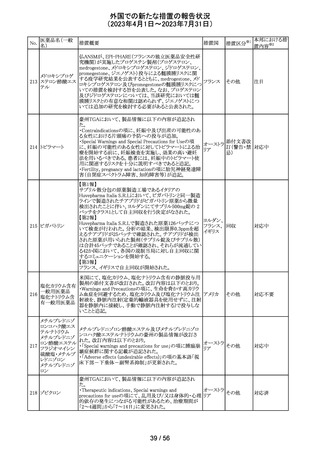
炭酸水素ナトリウムのCCDSにおいて、Contraindicationsに
「活性物質またはいずれかの賦形剤に対する過敏症」と記
炭酸水素ナトリウ
238
載されており、Special warnings and precautions for useに、 ドイツ
ム
心機能や腎機能に障害のある患者には注意が必要である
旨が記載されている。
その他
注目
米FDAはラベプラゾールについて安全性に関する表示を
ラベプラゾールナ
変更し、新たに泌尿器生殖器障害として「勃起不全」が追
トリウム
加された。
その他
注目
No.
医薬品名(一般
名)
措置概要
措置国
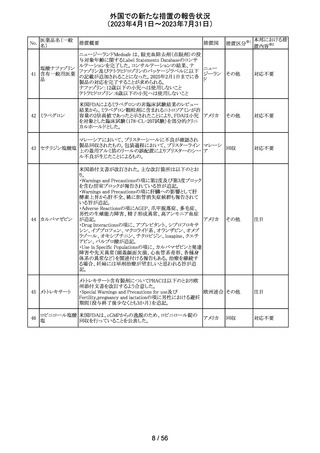
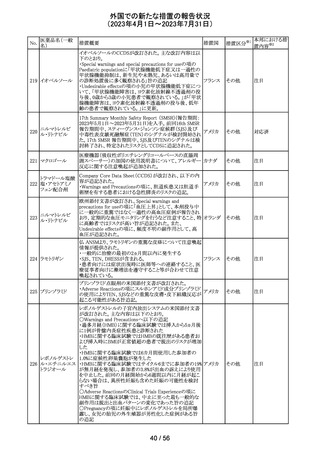
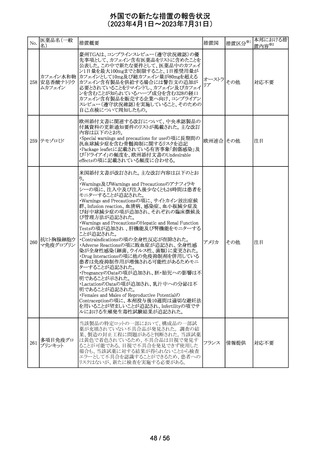
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2023/5/16~2023/6/15)を入手
した。報告対象期間に入手したBNT162b2の安全性及び有
効性データから、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である(以下抜粋)。
5. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジ
メント及びファーマコヴィジランス計画で反映された重要な
リスク及び不足情報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜
炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチ
ン関連の呼吸器疾患増強、ギラン・バレー症候群
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
のある患者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、
循環器疾患、活動性結核など)、自己免疫疾患患者又は
炎症性疾患患者、他のワクチンとの相互作用、長期安全性
データ、6カ月未満の乳児、ワクチンの有効性
6. OVERVIEW OF SAFETY SIGNALS DURING THE
コロナウイルス修
REPORTING INTERVAL
飾ウリジンRNAワ
237
報告対象期間中に対処もしくは評価中であったシグナルと アメリカ
クチン(SARS-
して、以下が記載されている。
CoV-2)
月経障害(Menstrual Irregularities):Not yet determined
(Ongoing)
網膜血管閉塞(Retinal Vascular Occlusion):Not yet
determined(New and Ongoing)
感音難聴(Sensorineural hearing loss):Not yet determined
(New and Ongoing)
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株
BA.1)、BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)
の報告期間における利用可能な安全性及び有効性データ
に基づくと、BNT162b2のベネフィット・リスクプロファイルは
引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基
づき、RSI(安全性参照情報)の変更や追加のリスク最小化
活動は必要とされない。
MAHは、すべての有害事象の報告を含むBNT162b2起源
株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)の安全
性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
239
アメリカ
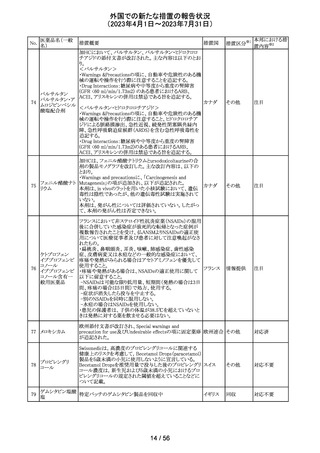
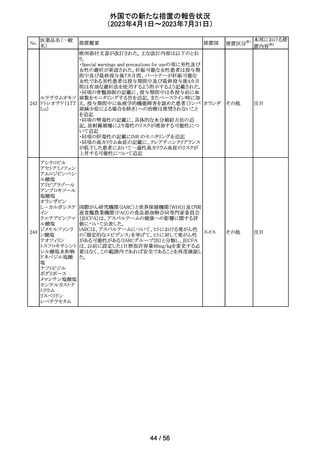
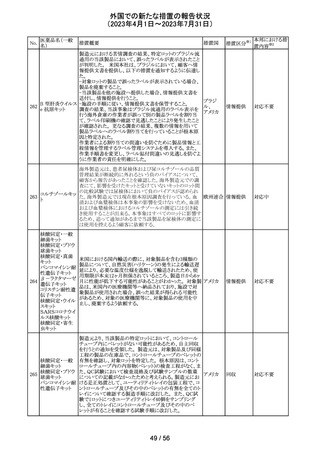
カメルーンにおいて、アセトアミノフェン、フェニレフリン塩酸
塩, クロルフェニラミンマレイン酸塩を含有するシロップ剤の
1バッチ(E22053)に、許容できない量のジエチルグリコー
クロルフェニラミン
カメルー
240
ル(28.6%)が含有されていることが判明し、WHOはMedical
その他
マレイン酸塩
ン
Product Alertを発出して、本製品の影響を受ける可能性の
ある国と地域におけるサーベイランス強化と使用禁止を要
求した。
42 / 56
対応不要
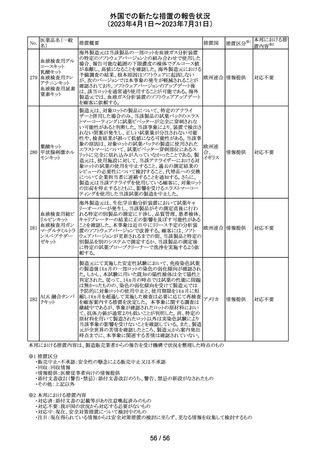
(2023年4月1日~2023年7月31日)
措置区分※1
本邦における措
置内容※2
その他
注目
炭酸水素ナトリウムのCCDSにおいて、Contraindicationsに
「活性物質またはいずれかの賦形剤に対する過敏症」と記
炭酸水素ナトリウ
238
載されており、Special warnings and precautions for useに、 ドイツ
ム
心機能や腎機能に障害のある患者には注意が必要である
旨が記載されている。
その他
注目
米FDAはラベプラゾールについて安全性に関する表示を
ラベプラゾールナ
変更し、新たに泌尿器生殖器障害として「勃起不全」が追
トリウム
加された。
その他
注目
No.
医薬品名(一般
名)
措置概要
措置国
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2023/5/16~2023/6/15)を入手
した。報告対象期間に入手したBNT162b2の安全性及び有
効性データから、BNT162b2のベネフィット・リスクプロファイ
ルは引き続き良好である(以下抜粋)。
5. SUMMARY OF SAFETY CONCERNS
報告対象期間の初期にBNT162b2の世界的なリスクマネジ
メント及びファーマコヴィジランス計画で反映された重要な
リスク及び不足情報として、以下が記載されている。
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜
炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強、ワクチ
ン関連の呼吸器疾患増強、ギラン・バレー症候群
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
のある患者(慢性閉塞性肺疾患、糖尿病、慢性神経疾患、
循環器疾患、活動性結核など)、自己免疫疾患患者又は
炎症性疾患患者、他のワクチンとの相互作用、長期安全性
データ、6カ月未満の乳児、ワクチンの有効性
6. OVERVIEW OF SAFETY SIGNALS DURING THE
コロナウイルス修
REPORTING INTERVAL
飾ウリジンRNAワ
237
報告対象期間中に対処もしくは評価中であったシグナルと アメリカ
クチン(SARS-
して、以下が記載されている。
CoV-2)
月経障害(Menstrual Irregularities):Not yet determined
(Ongoing)
網膜血管閉塞(Retinal Vascular Occlusion):Not yet
determined(New and Ongoing)
感音難聴(Sensorineural hearing loss):Not yet determined
(New and Ongoing)
8. CONCLUSION AND ACTIONS
BNT162b2起源株、BNT162b2 2価(起源株、オミクロン株
BA.1)、BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)
の報告期間における利用可能な安全性及び有効性データ
に基づくと、BNT162b2のベネフィット・リスクプロファイルは
引き続き良好である。
集積安全性データ及びベネフィット・リスク解析の評価に基
づき、RSI(安全性参照情報)の変更や追加のリスク最小化
活動は必要とされない。
MAHは、すべての有害事象の報告を含むBNT162b2起源
株、BNT162b2 2価(起源株、オミクロン株BA.1)、
BNT162b2 2価(起源株、オミクロン株BA.4/BA.5)の安全
性を引き続き検討し、安全性データの評価で重要な新たな
情報が得られた場合には、製品文書を改訂する。
239
アメリカ
カメルーンにおいて、アセトアミノフェン、フェニレフリン塩酸
塩, クロルフェニラミンマレイン酸塩を含有するシロップ剤の
1バッチ(E22053)に、許容できない量のジエチルグリコー
クロルフェニラミン
カメルー
240
ル(28.6%)が含有されていることが判明し、WHOはMedical
その他
マレイン酸塩
ン
Product Alertを発出して、本製品の影響を受ける可能性の
ある国と地域におけるサーベイランス強化と使用禁止を要
求した。
42 / 56
対応不要