よむ、つかう、まなぶ。
医療法第25条第1項の規定に基づく立入検査要綱の一部改正について (52 ページ)
出典
| 公開元URL | |
| 出典情報 | 医療法第25条第1項の規定に基づく立入検査要綱の一部改正について(5/31)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
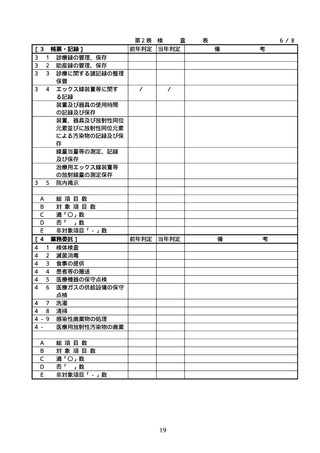
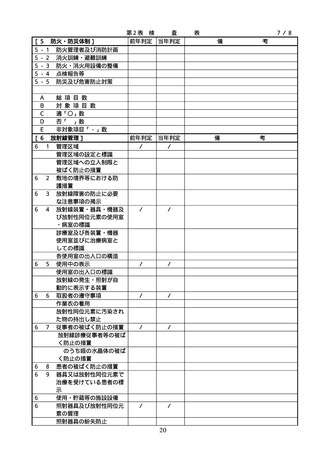
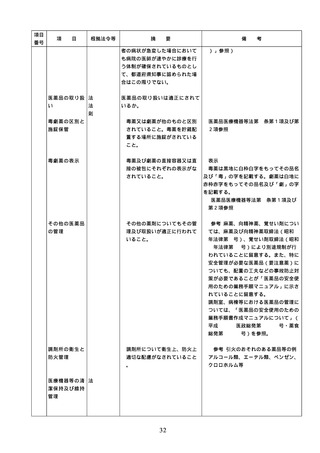
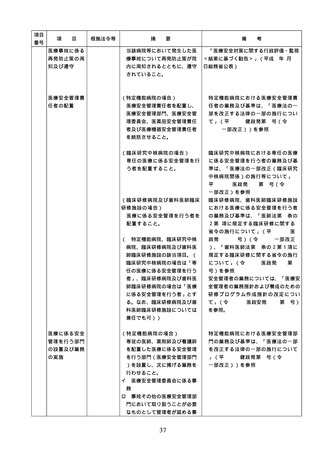
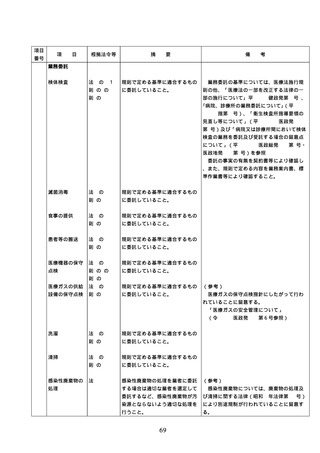
項目
番号
項
目
根拠法令等
摘
要
備
配置状況
考
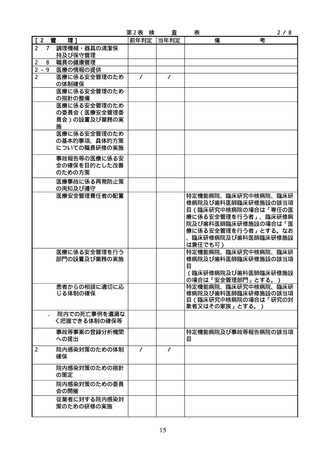
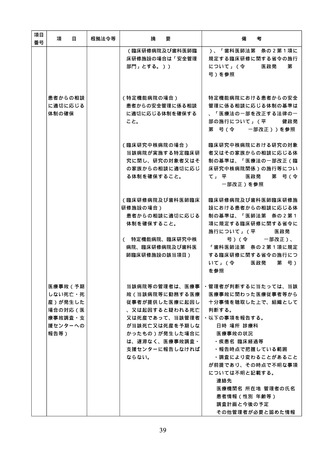
る。)のいずれかの資格を有しているこ
と。
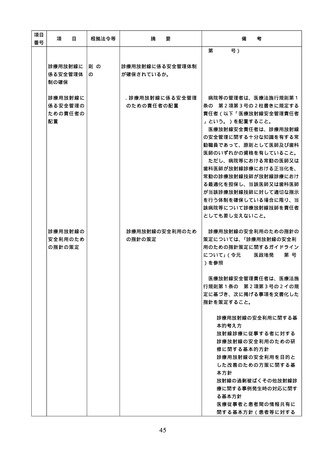
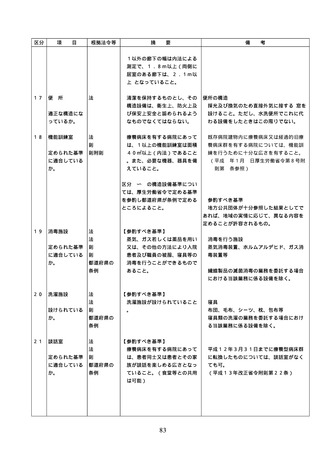
2. 従業者に対する
医薬品の安全使
2.従業者に対する医薬品の安全使
用のための研修の実施
従業者に対する医薬品の安全使用のため
の研修の内容については、具体的には次に
用のための研修
掲げる事項が考えられること。また、研修
の実施
の実施については必要に応じて行うことと
し、他の医療安全に係る研修と併せて実施
しても差し支えないこととすること。
① 医薬品の有効性・安全性に関する情報
、管理・使用方法に関する事項
② 医薬品の安全使用のための業務に関す
る手順書に関する事項
③ 医薬品による副作用等が発生した場合
の対応(施設内での報告、行政機関へ
の報告等)に関する事項
④ 医療安全、医薬品に関する事故防止対
策、特に安全管理が必要な医薬品(要
注意薬)に関する事項
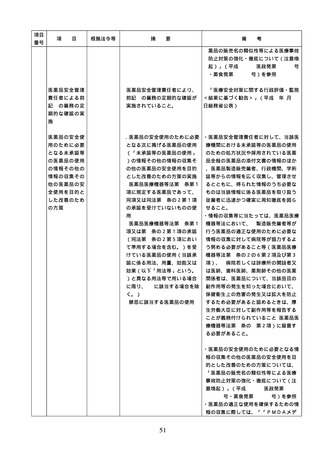
3. 医薬品の安全使
3.医薬品の安全使用のための業務
・医薬品の安全使用のための業務に関する
用のための業務
に関する手順書の作成及び当該
手順書(以下「医薬品業務手順書」という
に関する手順書
手順書に基づく業務の実施(従
。)については、医薬品の取扱いに係る業
の作成及び手順
業者による当該業務の実施の徹
務の手順を文書化したものであること。
書に基づく業務
底のための措置を含む。)
・病院及び患者を入院させるための施設を
の実施
有する診療所における医薬品業務手順書
の作成又は変更は、医療安全管理委員会
において協議した上で行うこと。
・医薬品業務手順書には、病院等の規模や
特徴に応じて、次に掲げる事項を含むも
のであること。
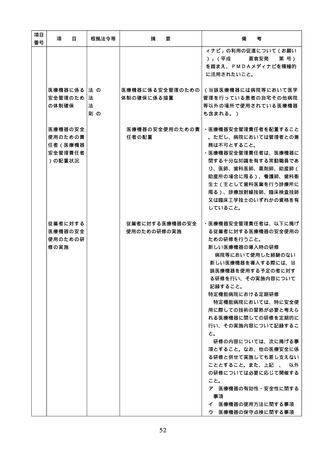
①
病院等で用いる医薬品の採用・購入に
関する事項(未承認新規医薬品等を採用
・購入するに当たっては、当該未承認新
規医薬品等の使用の妥当性について、関
係学会のガイドライン等の科学的知見を
確認するとともに、関係学会のガイドラ
イン等に記載がなく、科学的根拠が確立
していない未承認新規医薬品等の使用に
当たっては、新規医薬品等の使用に当た
っては、その有効性・安全性の検証を十
分に行うことを含む。)
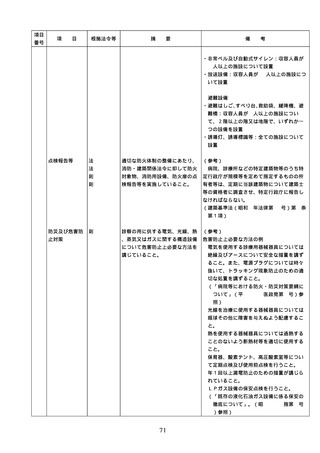
② 医薬品の管理に関する事項
(例=医薬品の保管場所、医薬品医療機
器等法などの法令で適切な管理が求め
られている医薬品(麻薬・向精神薬、
覚せい剤原料、毒薬・劇薬、特定生物
49
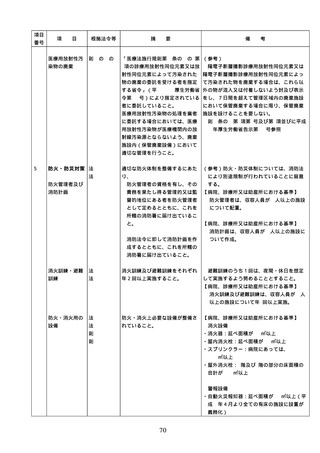
番号
項
目
根拠法令等
摘
要
備
配置状況
考
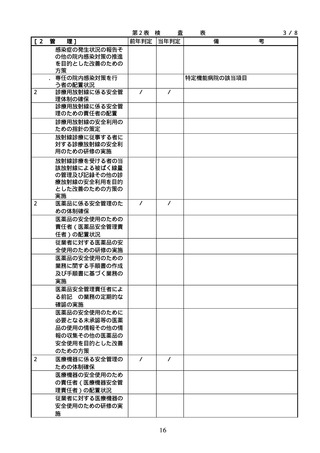
る。)のいずれかの資格を有しているこ
と。
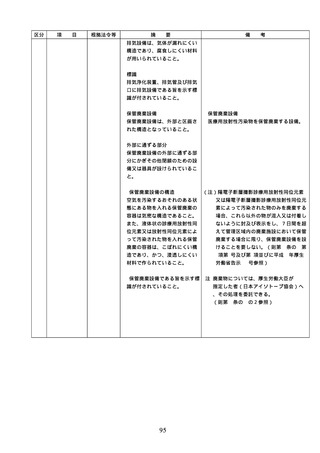
2. 従業者に対する
医薬品の安全使
2.従業者に対する医薬品の安全使
用のための研修の実施
従業者に対する医薬品の安全使用のため
の研修の内容については、具体的には次に
用のための研修
掲げる事項が考えられること。また、研修
の実施
の実施については必要に応じて行うことと
し、他の医療安全に係る研修と併せて実施
しても差し支えないこととすること。
① 医薬品の有効性・安全性に関する情報
、管理・使用方法に関する事項
② 医薬品の安全使用のための業務に関す
る手順書に関する事項
③ 医薬品による副作用等が発生した場合
の対応(施設内での報告、行政機関へ
の報告等)に関する事項
④ 医療安全、医薬品に関する事故防止対
策、特に安全管理が必要な医薬品(要
注意薬)に関する事項
3. 医薬品の安全使
3.医薬品の安全使用のための業務
・医薬品の安全使用のための業務に関する
用のための業務
に関する手順書の作成及び当該
手順書(以下「医薬品業務手順書」という
に関する手順書
手順書に基づく業務の実施(従
。)については、医薬品の取扱いに係る業
の作成及び手順
業者による当該業務の実施の徹
務の手順を文書化したものであること。
書に基づく業務
底のための措置を含む。)
・病院及び患者を入院させるための施設を
の実施
有する診療所における医薬品業務手順書
の作成又は変更は、医療安全管理委員会
において協議した上で行うこと。
・医薬品業務手順書には、病院等の規模や
特徴に応じて、次に掲げる事項を含むも
のであること。
①
病院等で用いる医薬品の採用・購入に
関する事項(未承認新規医薬品等を採用
・購入するに当たっては、当該未承認新
規医薬品等の使用の妥当性について、関
係学会のガイドライン等の科学的知見を
確認するとともに、関係学会のガイドラ
イン等に記載がなく、科学的根拠が確立
していない未承認新規医薬品等の使用に
当たっては、新規医薬品等の使用に当た
っては、その有効性・安全性の検証を十
分に行うことを含む。)
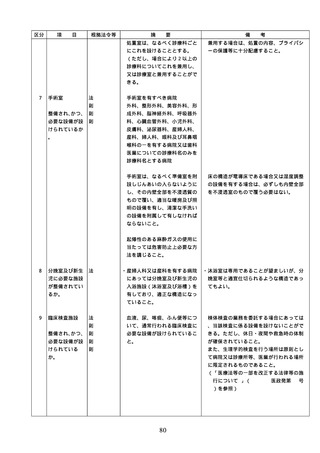
② 医薬品の管理に関する事項
(例=医薬品の保管場所、医薬品医療機
器等法などの法令で適切な管理が求め
られている医薬品(麻薬・向精神薬、
覚せい剤原料、毒薬・劇薬、特定生物
49