資料1-2-3-5 薬機法に基づく製造販売業者からの副反応疑い報告状況について(交互接種に係る報告症例・基礎疾患等及び症例経過) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00043.html |
| 出典情報 | 第80回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第5回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(6/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
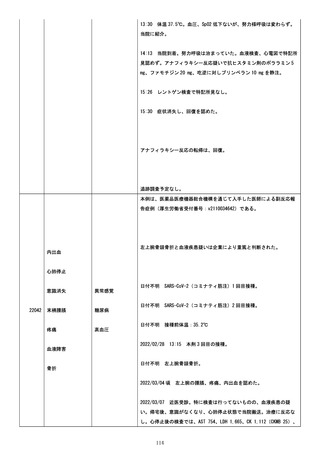
詳細は、ステロイド、抗アレルギー剤点滴で改善した。
心血管系について、以下の事象がはいとして報告された:
ショック、頻脈。
詳細は、上記同様だった。
皮膚/粘膜について、以下の事象がはいとして報告された:
全身性蕁麻疹(蕁麻疹)、全身性紅斑、皮疹を伴う全身性そう痒症。
詳細は、ワクチン接種 30 分後―約 5 時間 であった。一旦消退後、翌日
以降も一過性にありだった。
消化器について、以下の事象がはいとして報告された:腹痛。
詳細は、約 30 分後― 1 時間で消失した。
その他の症状について、詳細は体温上昇であった。皮フ症状と同様だっ
た。
2021/10/22(ワクチン接種 4 日後)、事象アナフィラキシーの転帰は回
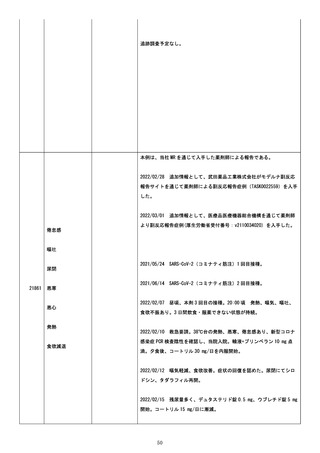
復であった。
2021/10/22、事象(アナフィラキシー反応、発疹、紅潮、発熱、動悸、
呼吸苦、腹痛)の転帰は回復であった。
残りのすべての事象の転帰は不明であった。
追加情報(2021/11/04):
同医薬情報担当者経由で連絡可能な同医師からの新規の追加報告。前報
で報告した主要な報告者は、看護師から医師に修正された。
追加情報(2021/11/22):
9