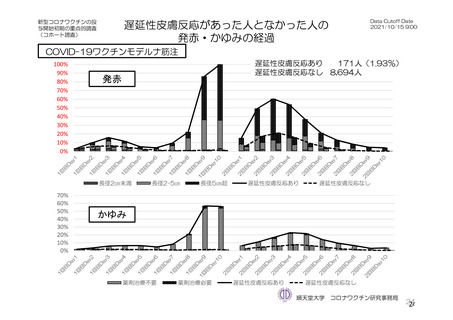
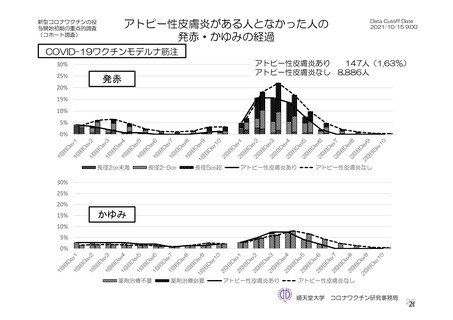
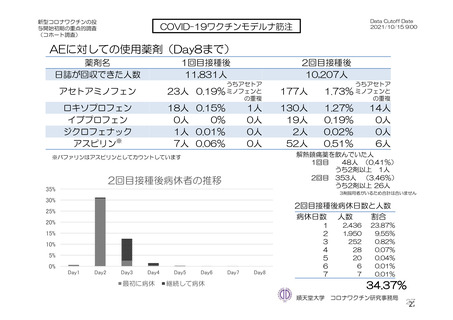
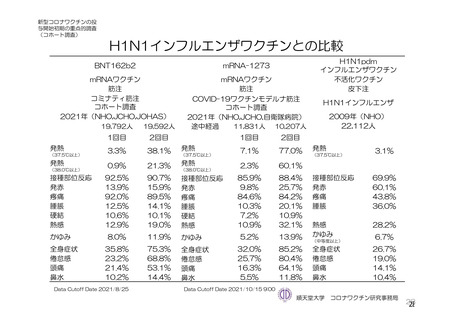
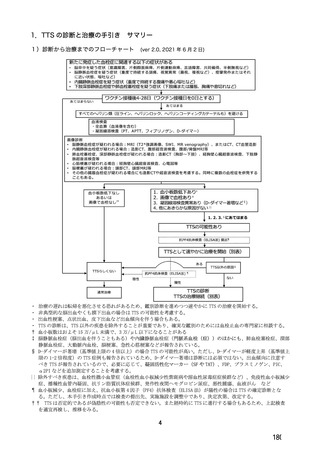
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (113 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
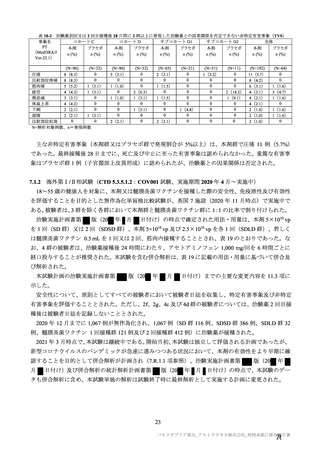
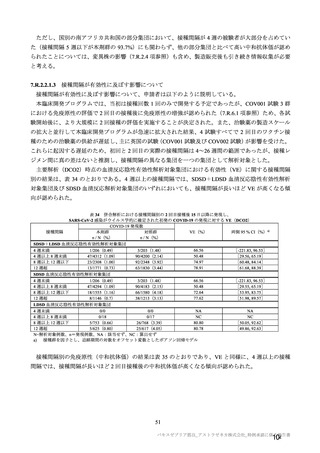
治験薬
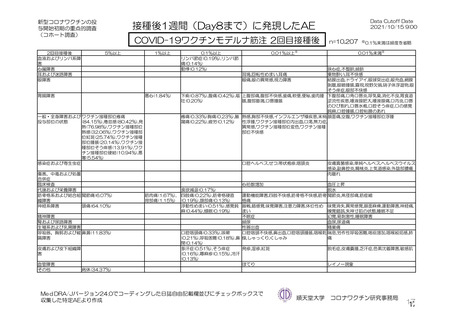
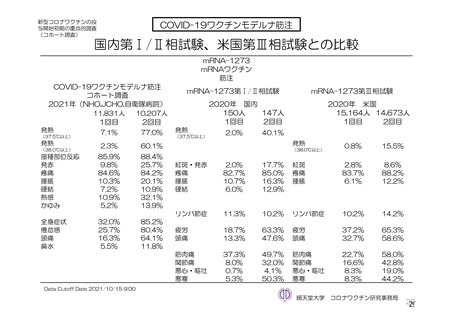
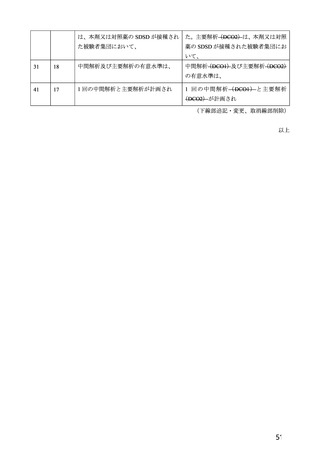
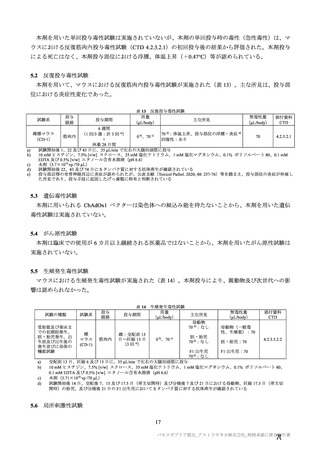
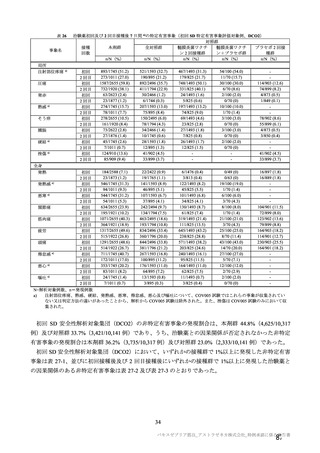
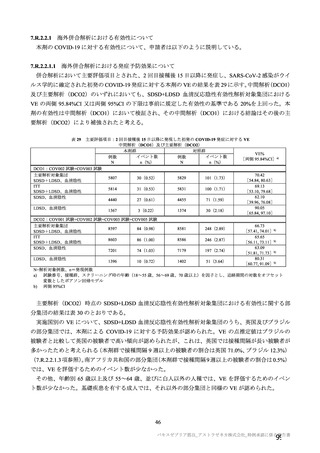
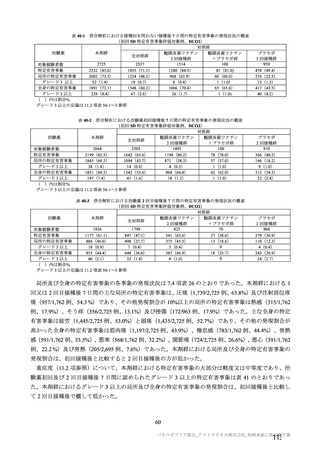
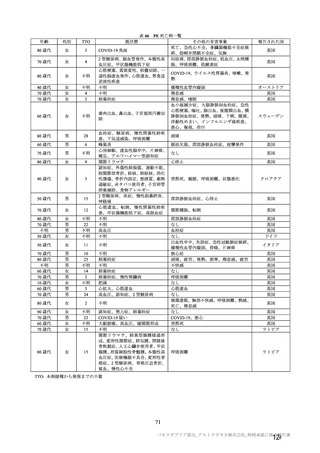
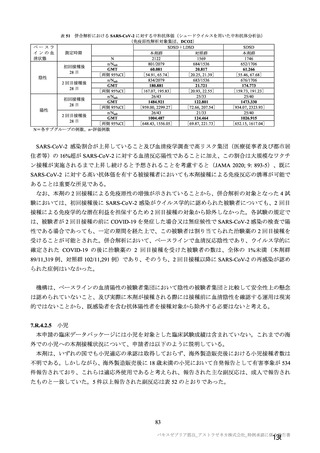
併合解析における接種回を問わない接種後 7 日間の特定有害事象の発現状況の概要
(初回 SD 特定有害事象評価対象例、DCO2)
対照群
本剤群
髄膜炎菌ワクチン
髄膜炎菌ワクチン
全対照群
2 回接種群
+プラセボ群
2725
2537
1514
100
2332(85.6)
1835(71.3)
1280(84.5)
81(81.0)
2002(73.5)
1224(48.3)
968(63.9)
60(60.0)
52(1.9)
19(0.7)
6(0.4)
1(1.0)
1991(73.1)
1548(60.2)
1066(70.4)
65(65.0)
229(8.4)
67(2.6)
26(1.7)
1(1.0)
対象被験者数
特定有害事象
局所の特定有害事象
グレード 3 以上
全身の特定有害事象
グレード 3 以上
( )内は割合%
グレード 3 以上の定義は 11.2 項表 56-1~3 参照
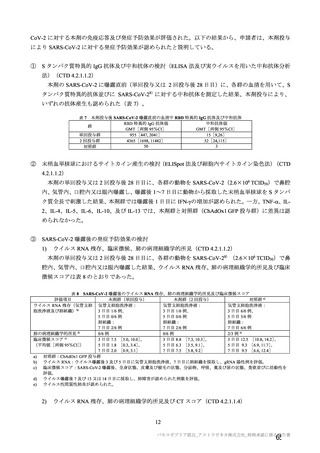
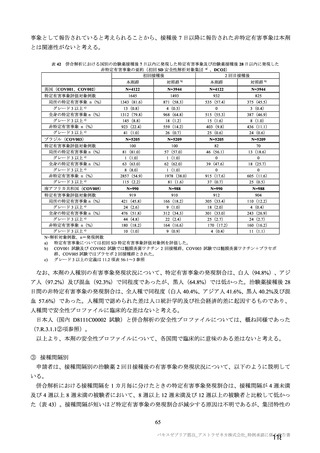
表 40-2
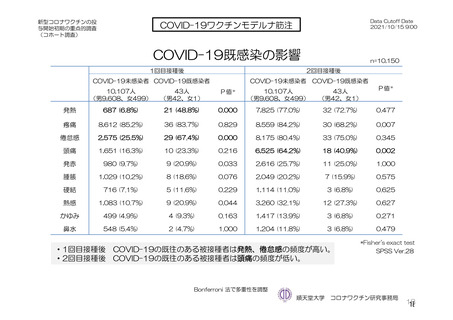
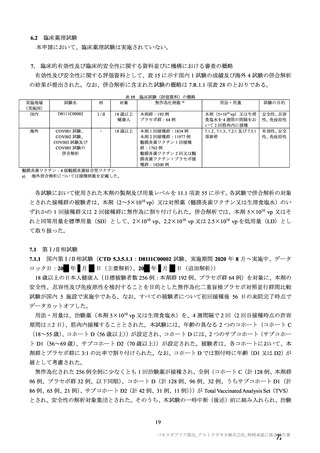
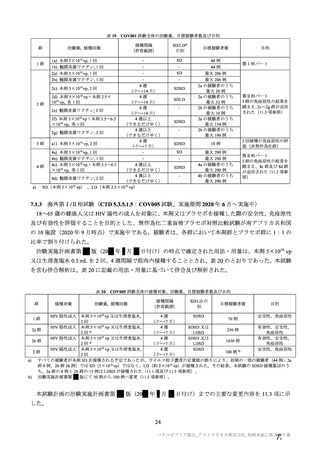
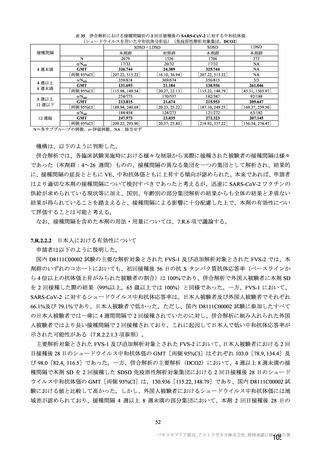
治験薬
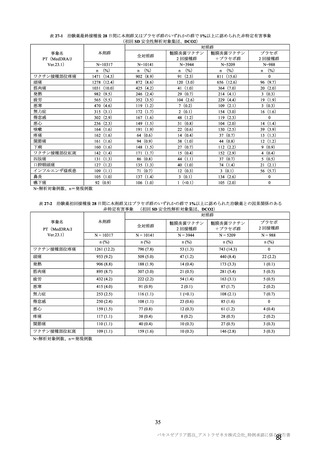
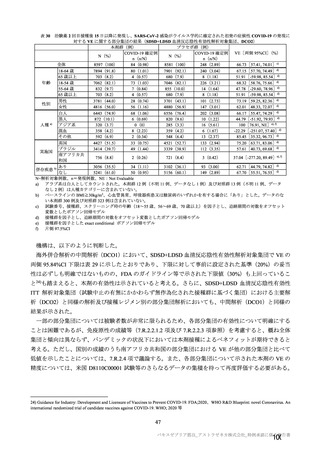
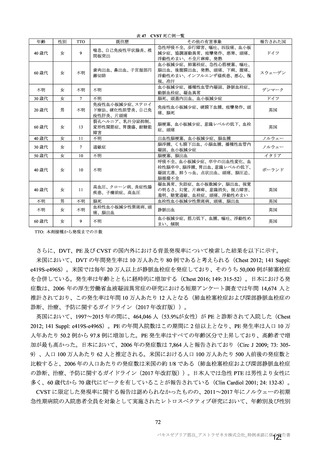
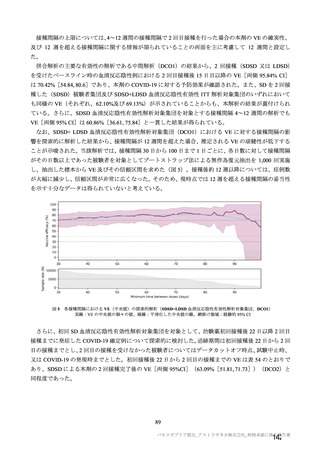
併合解析における治験薬初回接種後 7 日間の特定有害事象の発現状況の概要
(初回 SD 特定有害事象評価対象例、DCO2)
対照群
本剤群
髄膜炎菌ワクチン
髄膜炎菌ワクチン
全対照群
2 回接種群
+プラセボ群
2664
2503
1493
100
2199(82.5)
1642(65.6)
1198(80.2)
78(78.0)
1845(69.3)
1094(43.7)
871 (58.3)
57(57.0)
38(1.4)
14(0.6)
4(0.3)
1(1.0)
1851(69.5)
1342(53.6)
968(64.8)
62(62.0)
197(7.4)
41(1.6)
18(1.2)
1(1.0)
プラセボ
2 回接種群
959
474(49.4)
216(22.5)
12(1.3)
417(43.5)
40(4.2)
対象被験者数
特定有害事象
局所の特定有害事象
グレード 3 以上
全身の特定有害事象
グレード 3 以上
( )内は割合%
グレード 3 以上の定義は 11.2 項表 56-1~3 参照
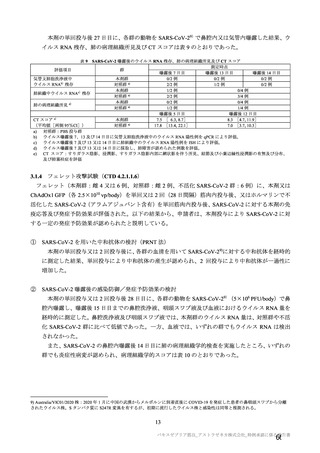
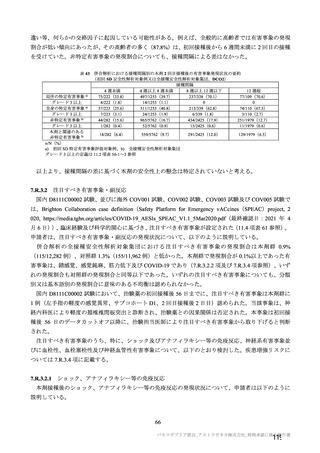
表 40-3
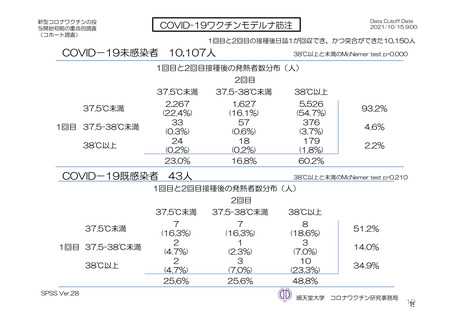
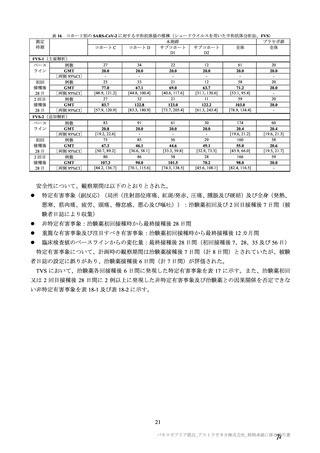
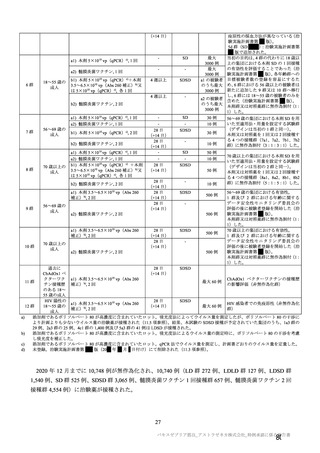
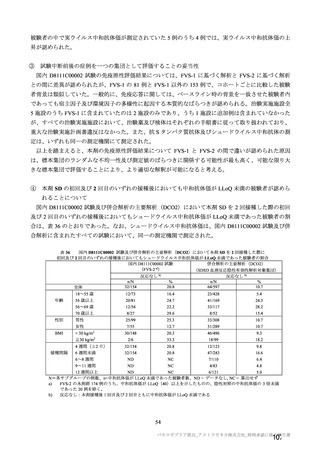
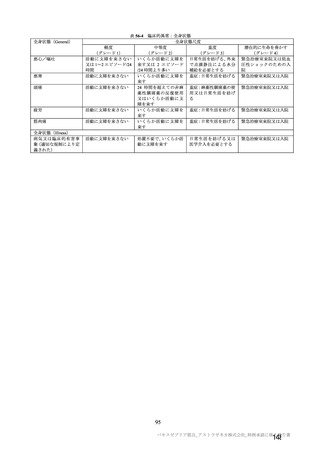
治験薬
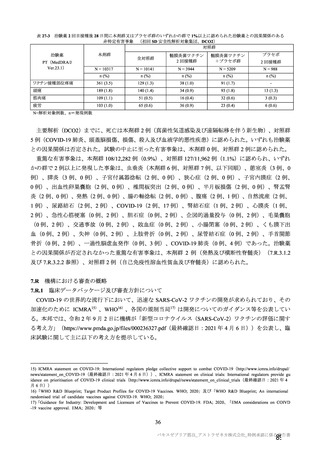
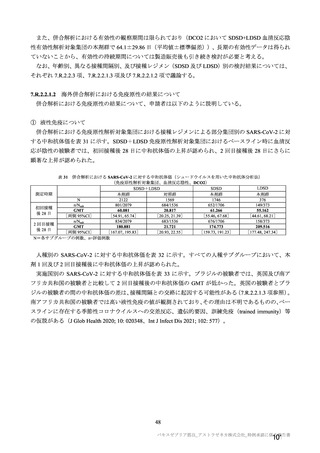
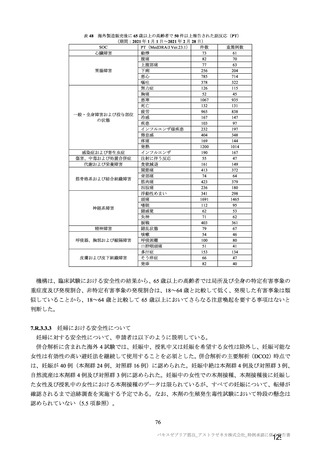
併合解析における治験薬 2 回目接種後 7 日間の特定有害事象の発現状況の概要
(初回 SD 特定有害事象評価対象例、DCO2)
対照群
本剤群
髄膜炎菌ワクチン
髄膜炎菌ワクチン
全対照群
2 回接種群
+プラセボ群
1926
1799
825
70
1177(61.1)
847(47.1)
541(65.6)
27(38.6)
886(46.0)
498(27.7)
375(45.5)
13(18.6)
0
18(0.9)
7(0.4)
3(0.4)
855(44.4)
648(36.0)
387(46.9)
18(25.7)
0
40(2.1)
32(1.8)
8(1.0)
プラセボ
2 回接種群
910
366(40.2)
166(18.2)
9(1.0)
312(34.3)
22(2.4)
対象被験者数
特定有害事象
局所の特定有害事象
グレード 3 以上
全身の特定有害事象
グレード 3 以上
( )内は割合%
グレード 3 以上の定義は 11.2 項表 56-1~3 参照
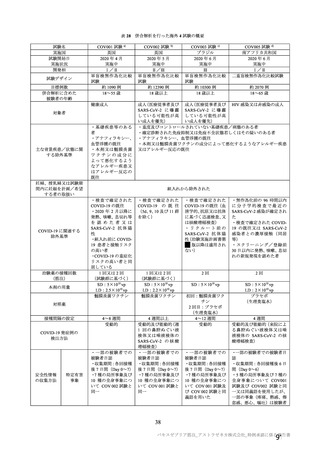
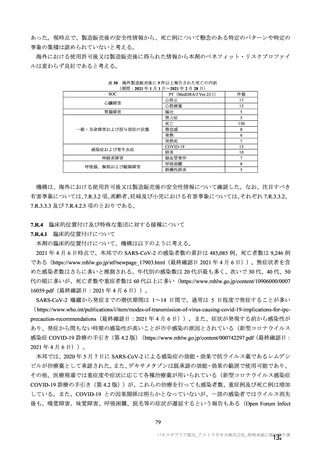
プラセボ
2 回接種群
904
279(30.9)
110(12.2)
4(0.4)
243(26.9)
24(2.7)
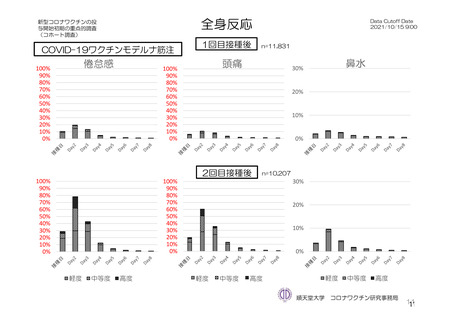
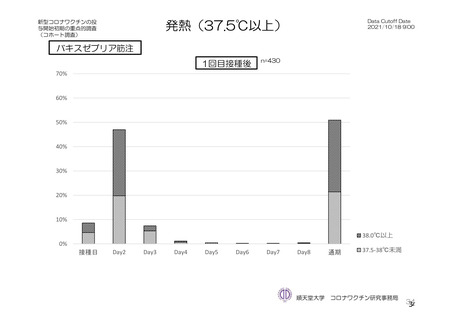
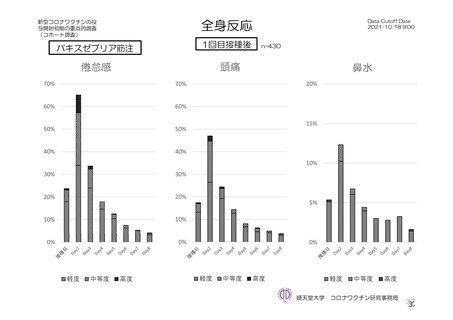
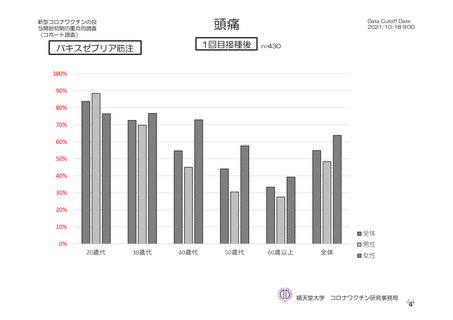
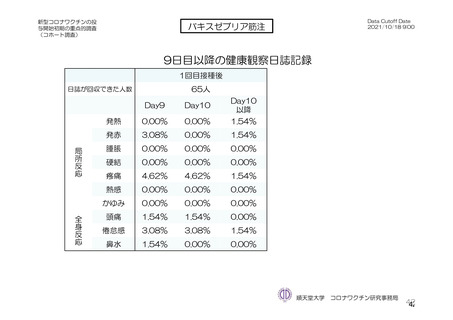
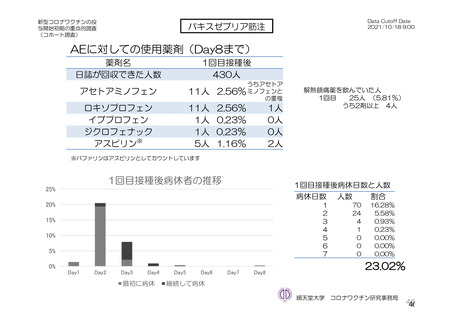
局所及び全身の特定有害事象の各事象の発現状況は 7.4 項表 26 のとおりであった。本剤群における 1
回又は 2 回目接種後 7 日間の主な局所の特定有害事象は、圧痛(1,739/2,725 例、63.8%)及び注射部位疼
痛(957/1,762 例、54.3 %)であり、その他発現割合が 10%以上の局所の特定有害事象は熱感(315/1,762
例、17.9%)、そう痒(356/2,725 例、13.1%)及び挫傷(172/963 例、17.9%)であった。主な全身の特定
有害事象は疲労(1,445/2,725 例、53.0%)と頭痛(1,435/2,725 例、52.7%)であり、その他の発現割合が
高かった全身の特定有害事象は筋肉痛(1,197/2,725 例、43.9%)、倦怠感(783/1,762 例、44.4%)、発熱
感(591/1,762 例、33.5%)、悪寒(568/1,762 例、32.2%)、関節痛(724/2,725 例、26.6%)、悪心(391/1,762
例、22.2 %)及び発熱(205/2,695 例、7.6%)であった。本剤群における局所及び全身の特定有害事象の
発現割合は、初回接種後と比較すると 2 回目接種後の方が低かった。
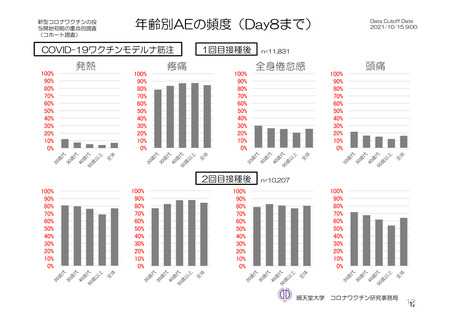
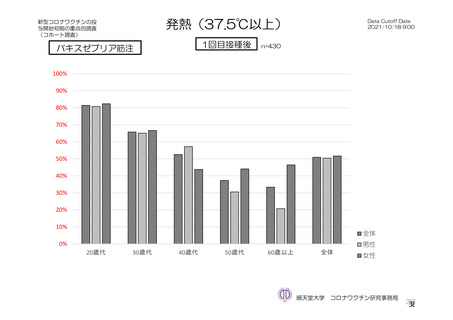
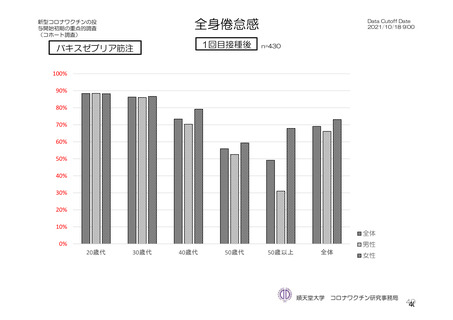
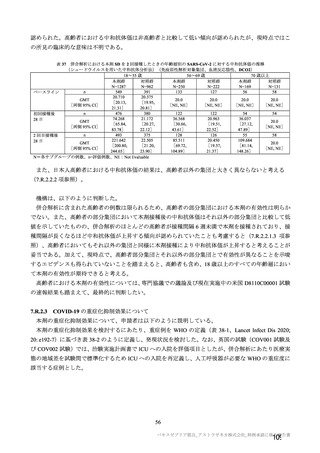
重症度(11.2 項参照)について、本剤群における特定有害事象の大部分は軽度又は中等度であり、治
験薬初回及び 2 回目接種後 7 日間に認められたグレード 3 以上の特定有害事象は表 41 のとおりであっ
た。本剤群におけるグレード 3 以上の局所及び全身の特定有害事象の発現割合は、初回接種後と比較し
て 2 回目接種後で概して低かった。
60
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
113