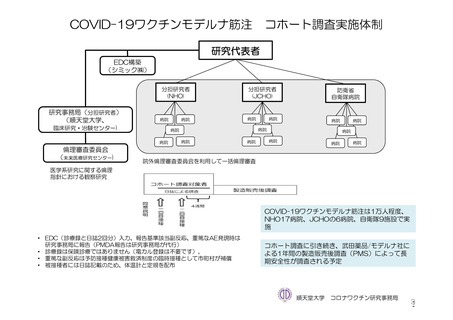
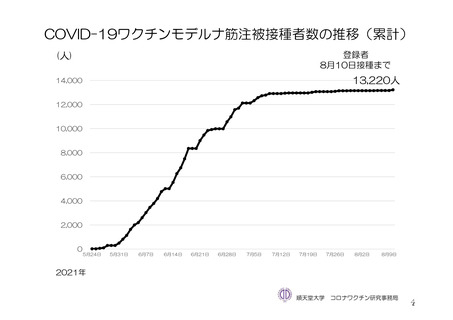
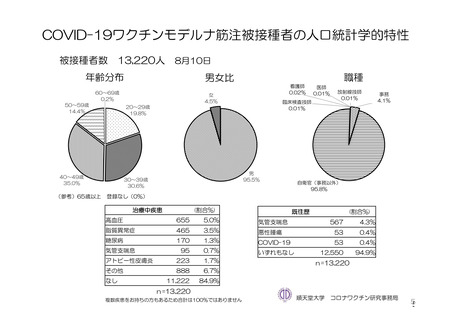
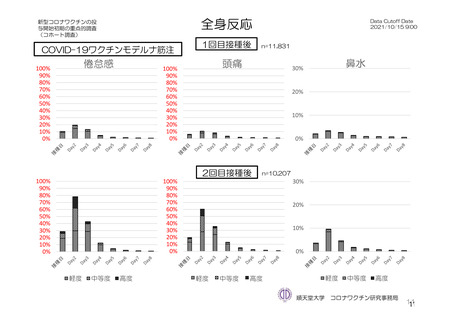
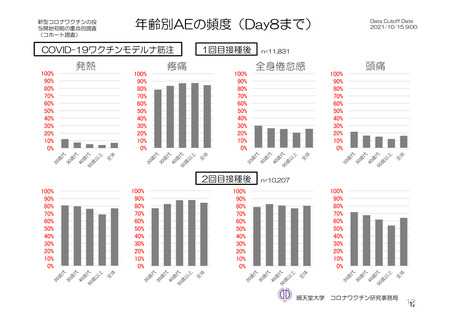
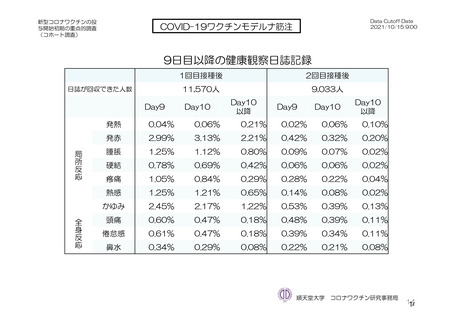
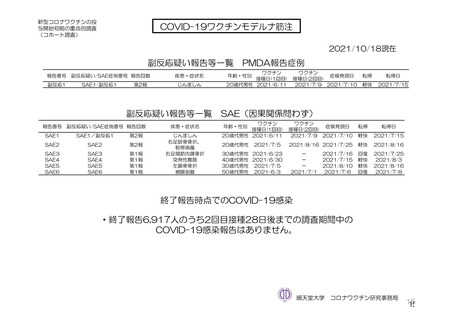
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (149 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
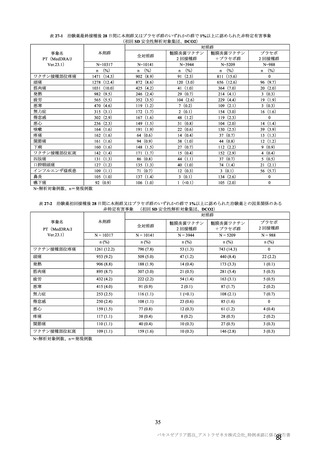
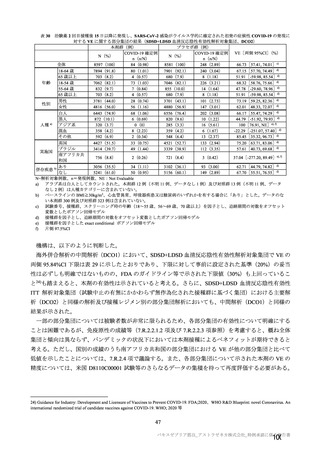
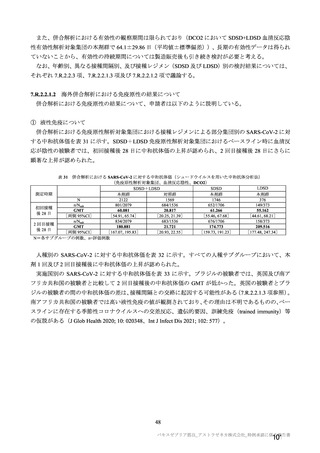
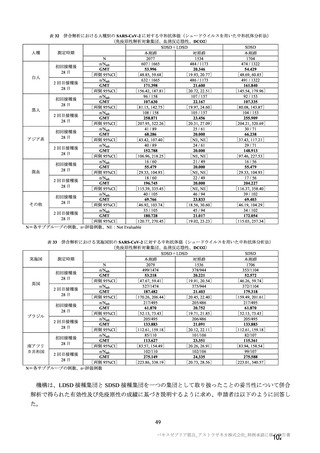
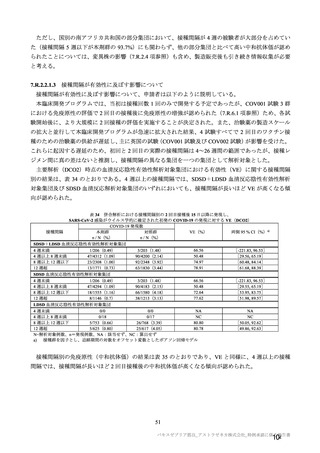
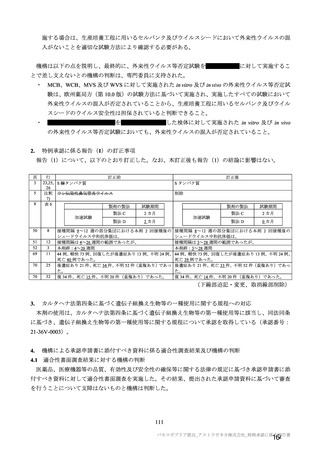
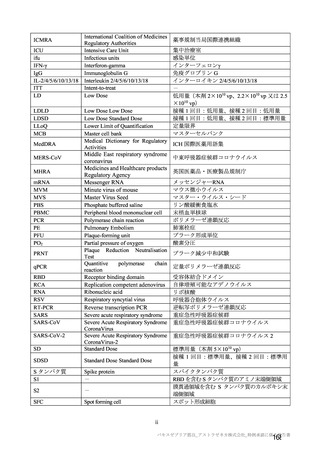
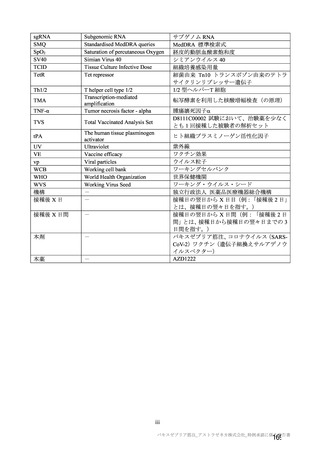
海外併合解析の対象とされた海外 4 試験の治験実施計画書の主要な変更経緯について
COV001 試験(7.1.2 項、
の治験実施計画書第
版:20
(20
年
年
月
月
版:20
版(20
年
年
月
日、最初の被験者の同意取得日:20
月
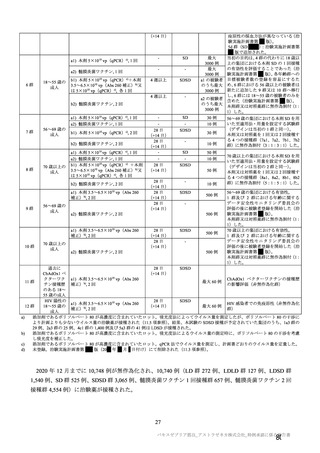
日付け)までの主要な改訂内容、COV002 試験(7.2.1 項、
日、最初の被験者の同意取得日:20
月
年
月
日)の治験実施計画書第
までの主要な改訂内容、及び COV005 試験(7.1.3 項、
年
月
版:20
版(20
日)の治験実施計画書第
月
日)
日)の治験実施計画書第
日付け)までの主要な改訂内容、COV003 試験(7.3.1 項、
最初の被験者の同意取得日:20
取得日:20
年
年
年
版:20
版(20
月
年
年
月
月
版
日、
日付け)
日、最初の被験者の同意
年
月
日付け)までの主要な改訂内容
月
日付け)までの主要な改訂内容
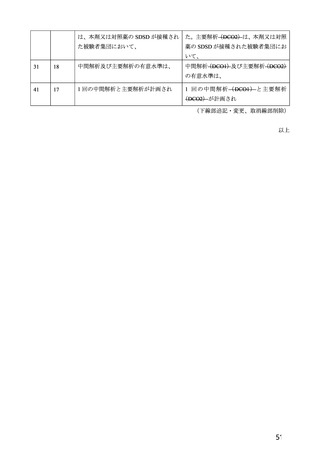
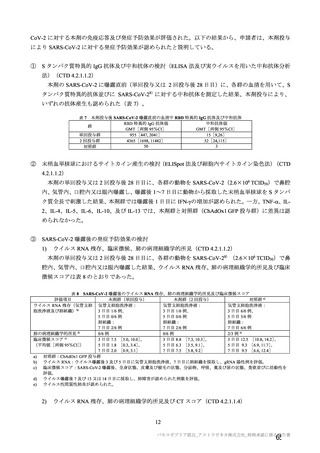
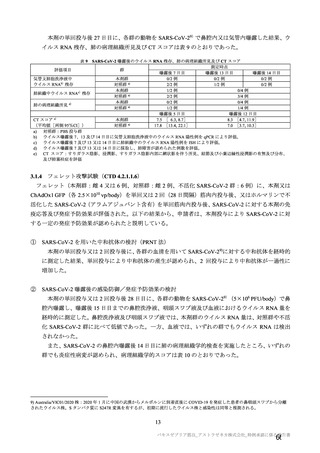
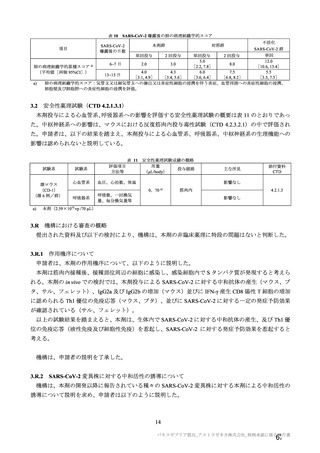
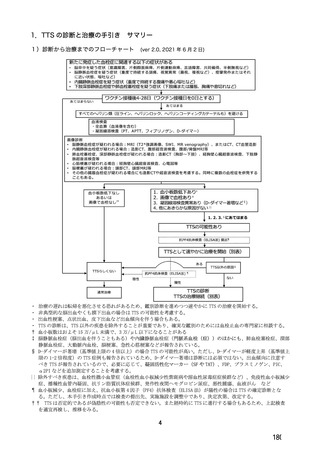
は、それぞれ表 57~60 のとおりである。
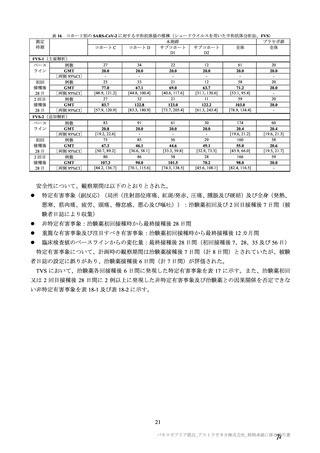
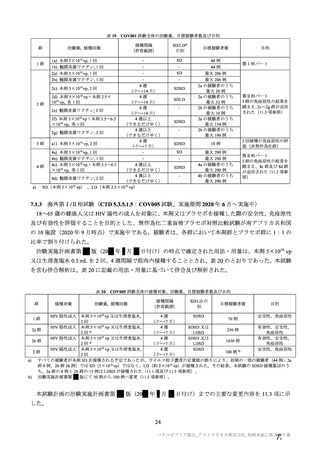
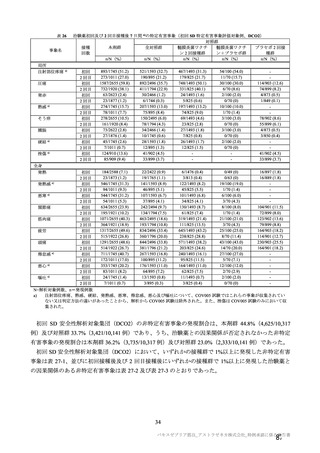
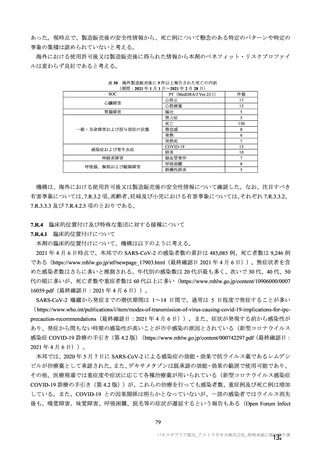
表 57
用法・用量
COV001 試験の治験実施計画書第
版(20
変更内容
(治験実施計画書版番号)
①3 群の 2 回目接種として低用量(2.5×1010 vp)を導入
(
版、20 年 月
日)
②4 群の一部の被験者でアセトアミノフェンの予防投与
を追加(
版、20 年 月 日)
版、
③3 群の 2 回目接種量を 5×1010 vp に戻す(
20 年 月
日)
④2 群の一部の被験者に対し 2 回目接種を追加(
版、20 年 月
日)
⑤2 及び 4 群の全被験者に対し 2 回目接種を追加(
版、20 年 月
日)
対照薬
生理食塩水プラセボを実薬対照(髄膜炎菌ワクチン)に
置き換え(
版、20 年 月 日)
症例数
①4 群を追加し、被験者数を 500 例から 1112 例に増加
(
版、20 年 月
日)
②使用できる実際のバイアル数を反映して被験者数を
1090 例に更新(
版、20 年 月 日)
除外基準
主要評価項目
組入れ前の無臭覚及び味覚喪失を除外基準に追加。
(
版、20 年 月
日)
①ぬぐい液検体検査の対象とする症候性患者の定義に
European Centre for disease prevention and Control の定義を
適用。試験実施チームに連絡する場合を「発熱、咳嗽、
息切れ、何らかの理由で入院した場合」に改訂(
版、20 年 月
日)
②ぬぐい検体検査のトリガーに嗅覚/味覚の消失を追加
(
版、20 年 月
日)
③ぬぐい検体検査に関して変更(症状を有するが S0 で
陰性の場合に在宅検査を追加、2 回目のぬぐい検体採取
のための S3-S5 受診を追加)(
版、20 年 月
日)
年
変更理由
①低用量の 2 回目接種の評価を可能とするため。
②アセトアミノフェンと併用投与したときの安全性、副反
応、免疫原性及び有効性を評価するため。
③COV002 試験における 2 回目接種との整合性をとるため。
④一部の被験者において 2 回目接種の安全性及び免疫原性を
評価するため。
⑤3 群の免疫原性の中間結果から、1 回接種と比較して 2 回
接種で中和抗体価が改善することが示されたため。
意図しない被験者の盲検解除の可能性を最小化し、副反応や
安全性報告及び/又は症候性 COVID-19 が発症した場合の健
康関連の被験者の行動におけるバイアスを軽減するため。
①より多く治験薬を確保でき、実薬群の被験者を増加するこ
とが可能となったため。
②当初の予定より多く治験薬を確保でき、被験者数の増加、
並びに中間及び主要解析までの期間短縮を可能とした。
過去に COVID-19 を発症した可能性があるが臨床検査で確認
しなかった被験者を除外するため、発熱、咳嗽及び息切れに
加えて追加。
①疑い症例を確実に検査、判定の対象とするため。
②疑い症例が、確実に検査、判定の対象となることを目的と
し、COVID-19 の症状に関する情報の更新に対応した症状の
基準へと改訂した。嗅覚/味覚の消失は、世界的流行の発生
から数カ月後に COVID-19 の症状として報告され、2020 年 4
月 17 日に、CDC はウイルス曝露後 2~14 日後に現れる可能
性のある症状一覧に「新規の味覚あるいは嗅覚の消失」を追
加した。2020 年 5 月 4 日、WHO はウェブサイトの Q&A の
COVID-19 症状リストに「味覚あるいは嗅覚の消失」を追加
した。
③症例を最大限特定するため。
96
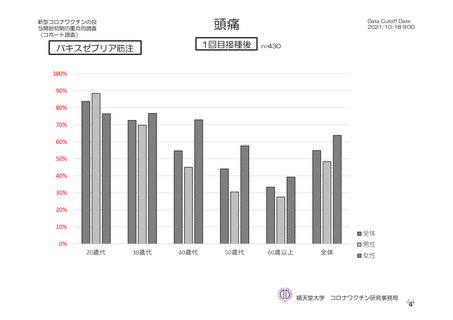
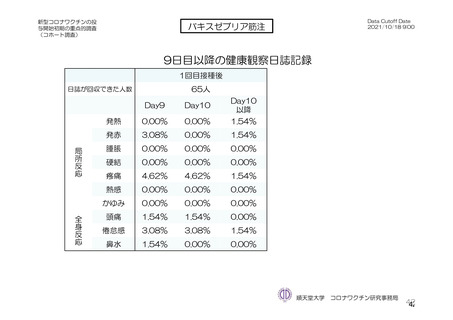
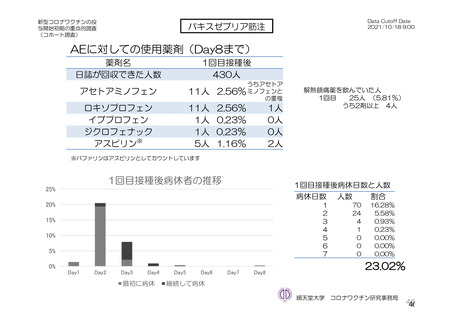
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
149