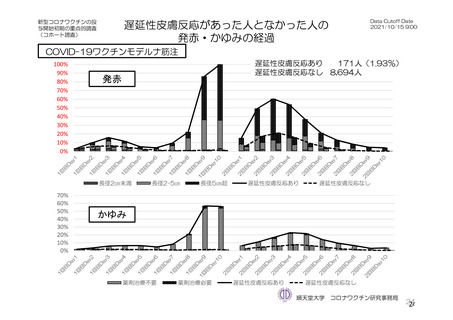
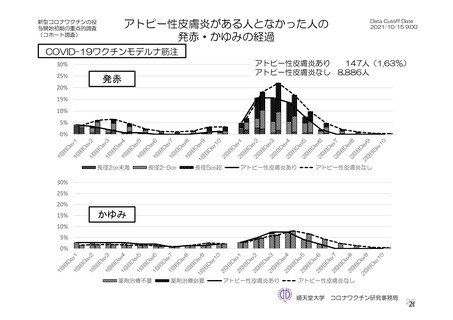
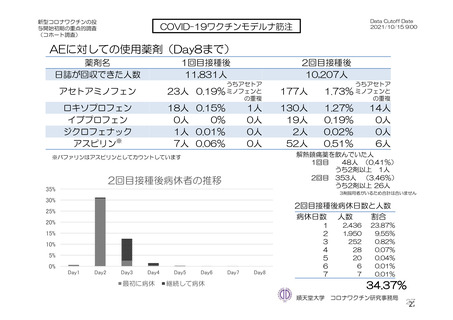
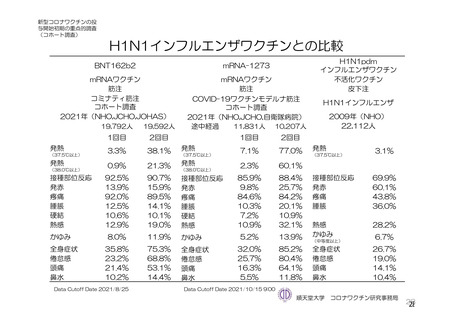
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (94 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
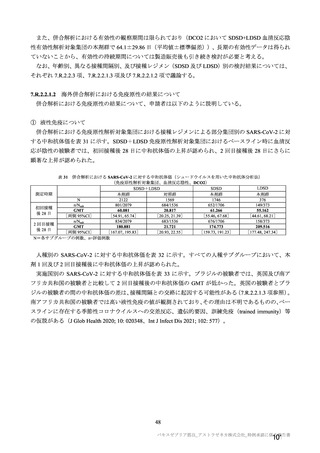
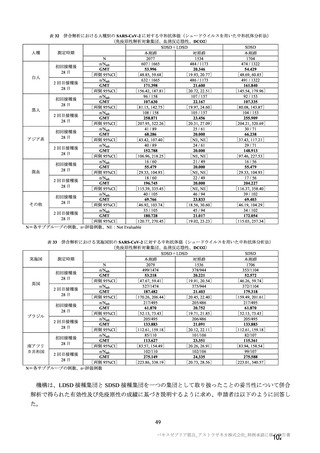
本剤の有効性及び安全性を早期に評価すること、並びに MHRA 及び EMA がワクチン使用に関する決定
を 2020 年末又は 2021 年早期に行うための根拠データを提供することを目的として、実施中の海外 4 試
験(COV001 試験、COV002 試験、COV003 試験及び COV005 試験)の併合解析に基づき、本剤の有効
性及 び安全性を 迅速に評価 する方法を 選択した。 一方、現在 、米国を中 心に本剤の 第Ⅲ相試験
(D8110C00001 試験)が実施中であるが、D8110C00001 試験を本邦の製造販売承認申請に用いる場合、
製造販売承認取得が遅れる可能性がある。したがって、本邦の製造販売承認申請にあたり、海外 4 試験
の併合解析を本剤の有効性及び安全性を評価するための主要な試験として位置付け、国内臨床試験を加
えて臨床データパッケージを構築した。
機構は、臨床データパッケージについて、以下のように判断した。
迅速なワクチンの開発が求められている状況において、米国 D8110C00001 試験の結果が得られる時期
を考慮すると、海外の発症予防効果を検証する主要な成績として 4 試験の併合解析の結果を用いること
はやむを得ず、7.R.1.1 項における検討も踏まえると申請者の提示する臨床データパッケージにて本剤の
審査を行うことは可能と考える。
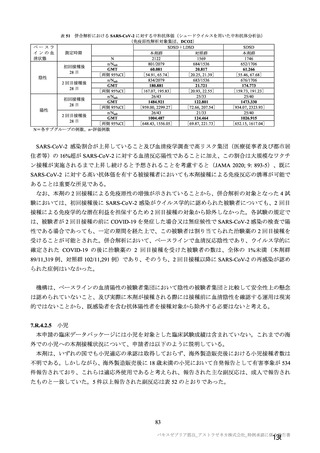
なお、併合解析(7.4 項参照)の有効性及び安全性については、以下の方針に基づき評価した。
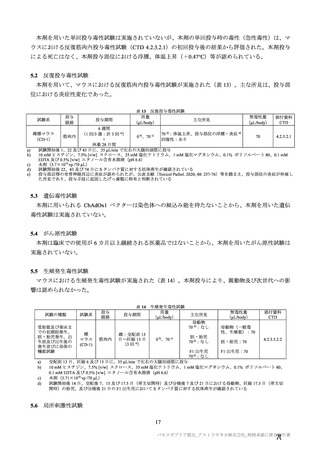
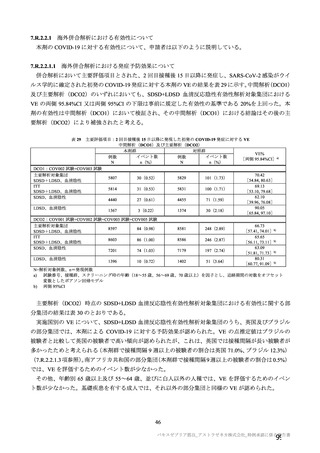
有効性については、1 回の中間解析(DCO1)と主要解析(DCO2)が計画され(統計解析計画書第
版、20
年
月
日付け)、中間解析(DCO1)において本剤の有効性が検証されたことから、
中間解析(DCO1)の成績を併合解析における有効性の検証的な結果と位置付け、主要解析(DCO2)
の成績については中間解析(DCO1)の成績の補足的な位置付けとされた。一方、主要解析(DCO2)
の評価対象集団では、中間解析(DCO1)の評価対象集団に比べてより長期間の観察がなされ、より
多様な背景を有するより多くの被験者が含まれることを踏まえ、審査においては、主要な有効性は
中間解析(DCO1)の結果に基づき評価するものの、有効性の詳細な検討や安全性の検討は主要解析
(DCO2)の結果に基づき行った。
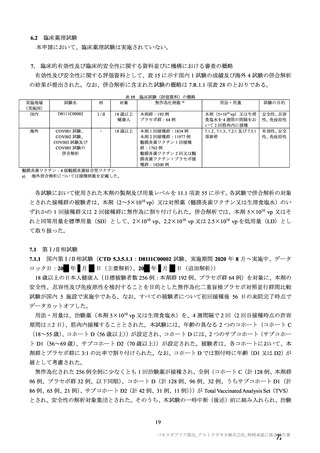
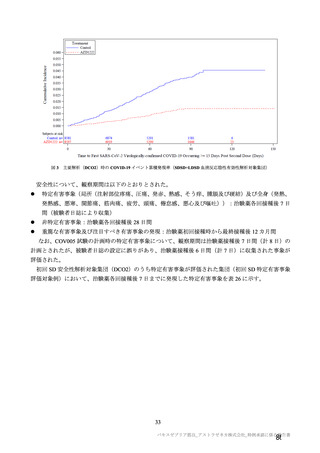
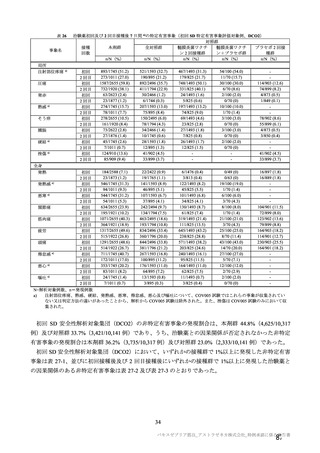
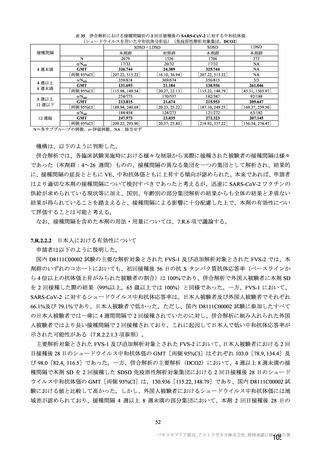
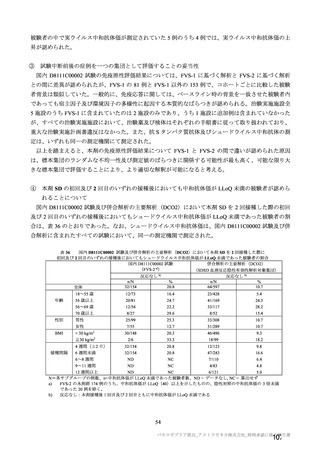
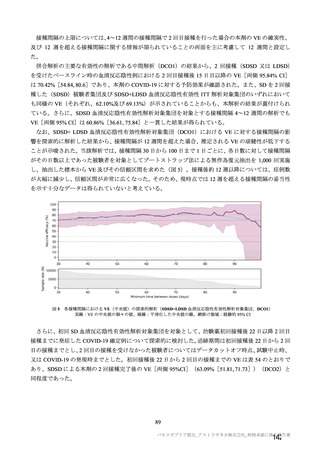
本剤の安全性プロファイルの評価にあたっては、初回 SD 安全性解析対象集団の結果に基づき評価
を行い、重篤な有害事象及び注目すべき有害事象については全接種安全性解析対象集団における結
果を評価した。なお、特定有害事象については、初回 SD 安全性解析対象集団のうち被験者日誌に
より特定有害事象が収集された被験者を初回 SD 特定有害事象評価対象例として評価した。
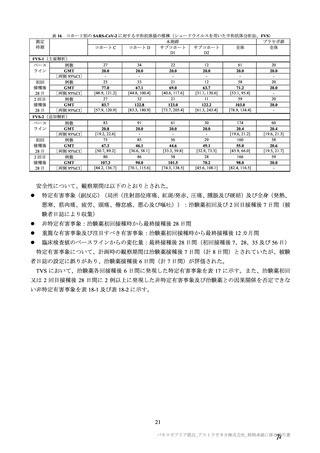
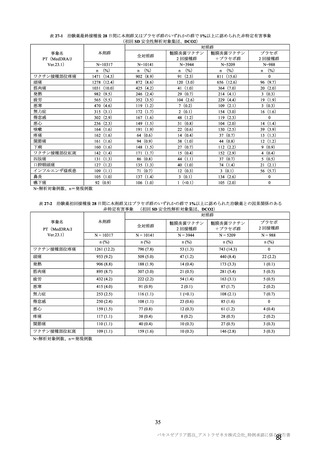
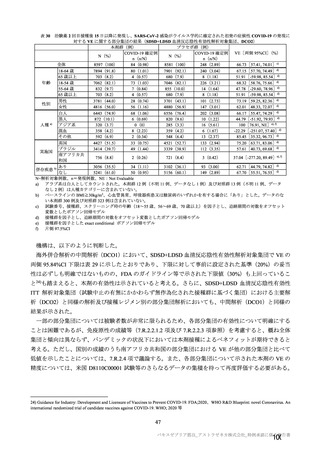
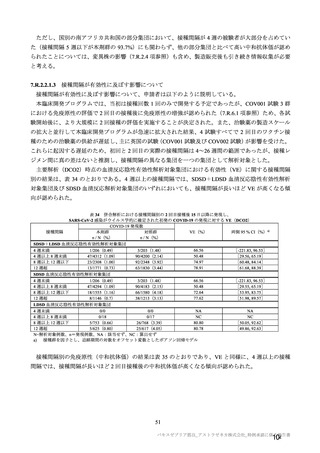
有効性の対照群について、各国における臨床試験の実施可能性等から、髄膜炎菌ワクチン 2 回接種
群、髄膜炎菌ワクチン(初回)及びプラセボ(2 回目)接種群、並びにプラセボ 2 回接種群が混在
していたが、いずれの対照薬にも SARS-CoV-2 に対する有効成分は含まれておらず、SARS-CoV-2
感染や COVID-19 発症のリスク曝露又は経過に影響しないと推測されることから、併合解析におけ
る有効性評価にあたり、複数の対照を併合した群を対照群として評価を行った。
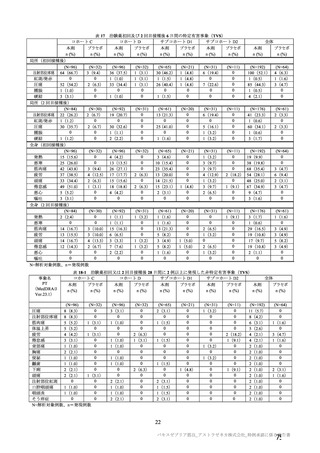
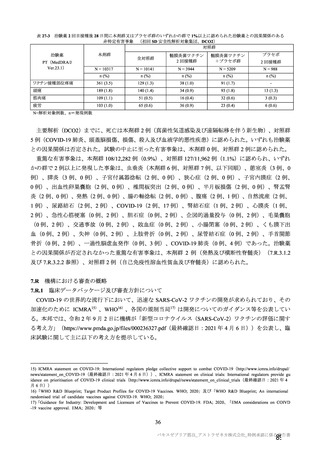
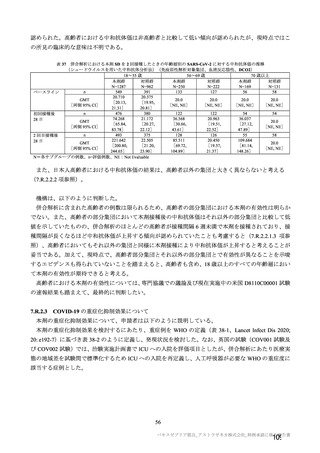
安全性の対照群について、申請資料においては有効性の対照群と同様に、複数の対照を併合した群
が一つの対照群として取り扱われていたが、安全性評価を行う上では実薬対照群とプラセボ対照群
を分けて評価することが適切と考えたことから、髄膜炎菌ワクチン 2 回接種群、髄膜炎菌ワクチン
(初回)及びプラセボ(2 回目)接種群、並びにプラセボ 2 回接種群の 3 群に分けて評価を行った。
7.R.2
7.R.2.1
有効性について
有効性の主要評価について
41
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
94