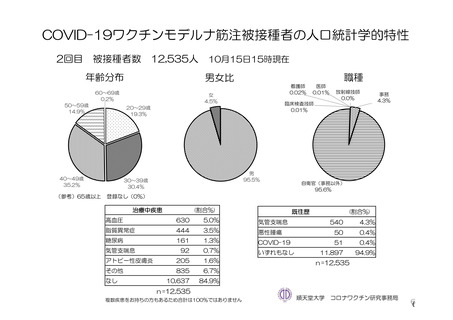
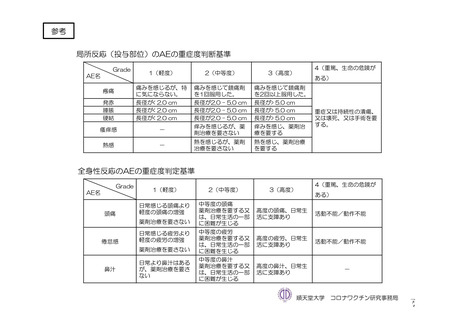
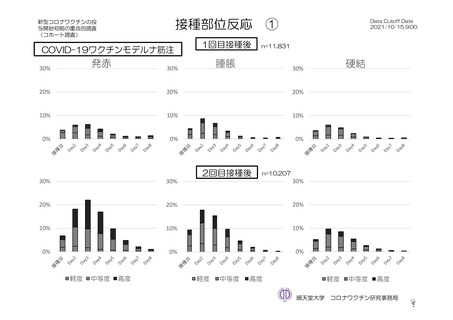
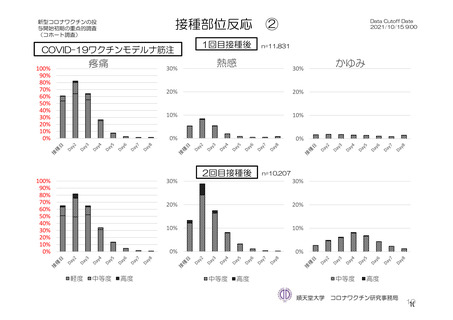
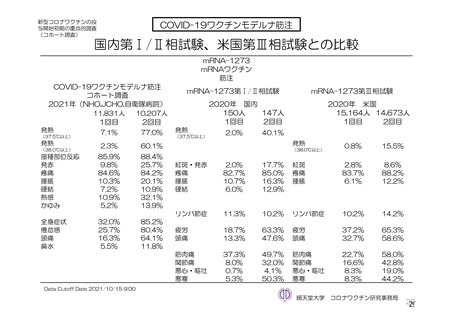
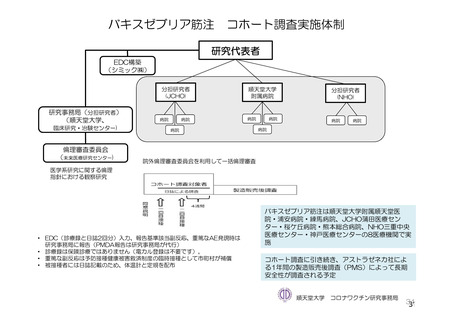
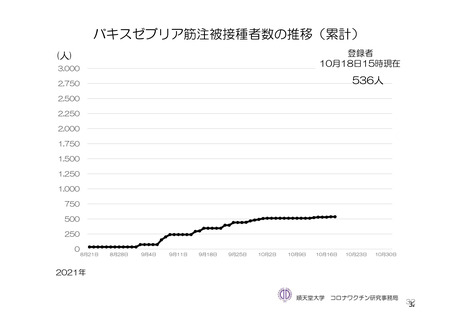
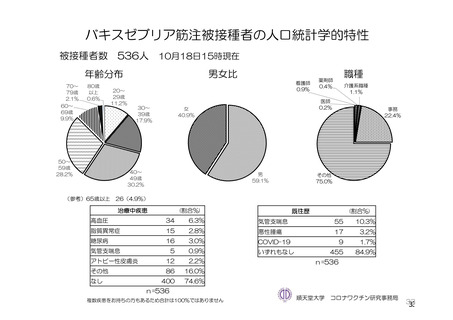
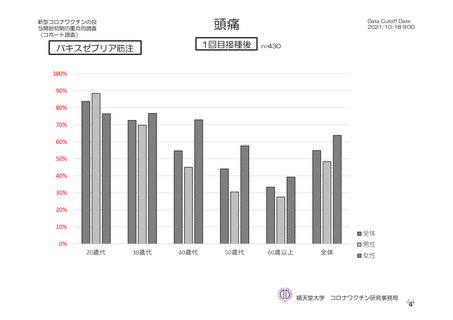
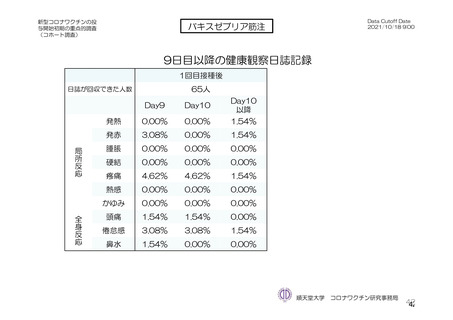
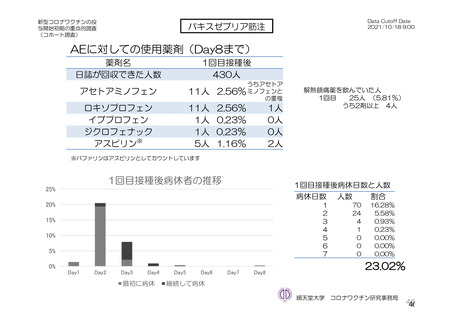
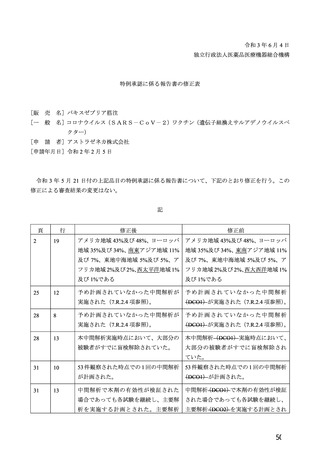
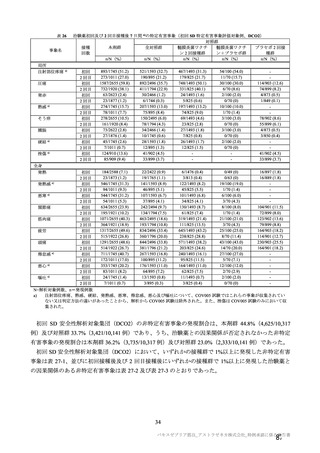
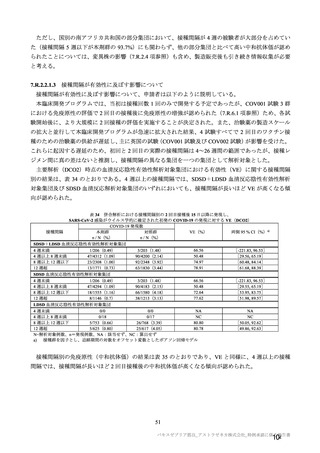
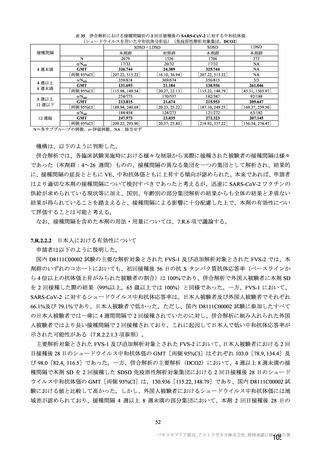
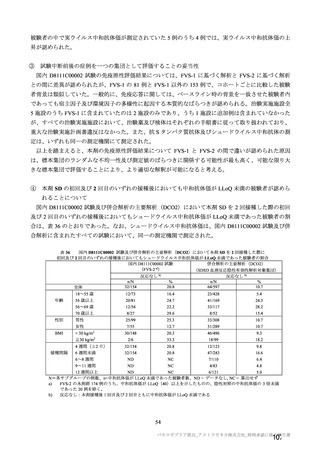
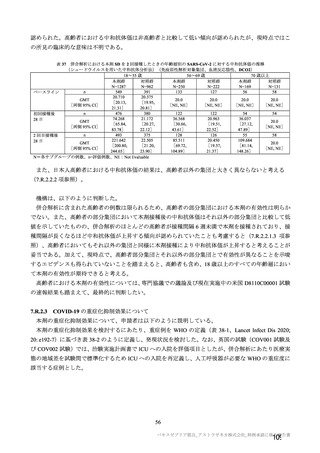
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
と。
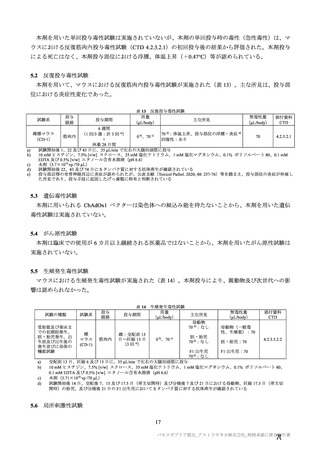
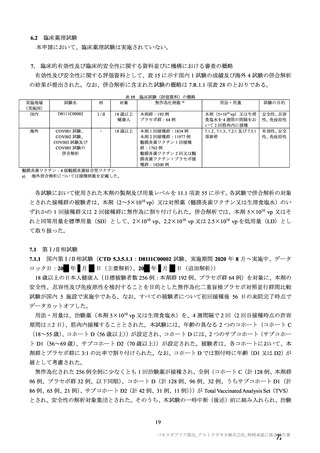
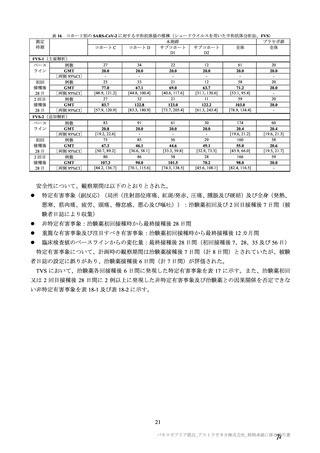
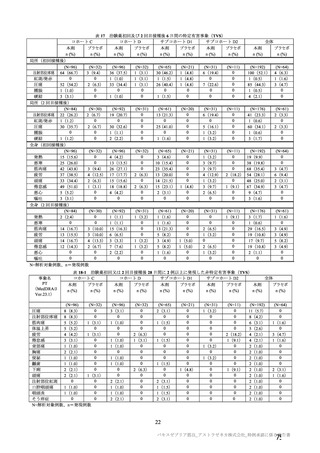
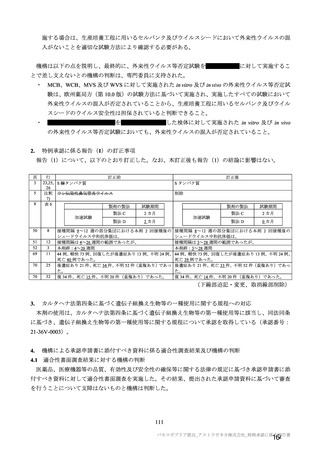
4. 本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された
特例承認品目であり、承認時において長期安定性等に係る情報は限られて
いるため、製造販売後も引き続き情報を収集し、報告すること。
5. 本剤の接種に際し、本剤の有効性及び安全性については今後も情報が集積
されることを踏まえ、あらかじめ被接種者又は代諾者に最新の有効性及び
安全性に関する情報が文書をもって説明され、予診票等で文書による同意
を得てから接種されるよう、医師に対して適切に説明すること。
6. 医薬品医療機器等法施行規則第 41 条に基づく資料の提出の猶予期間は、承
認取得から起算して 6 カ月とする。上記に基づいて提出された資料等によ
り、承認事項を変更する必要が認められた場合には、医薬品医療機器等法
第 74 条の 2 第 3 項に基づき承認事項の変更を命ずることがあること。
49