参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (79 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
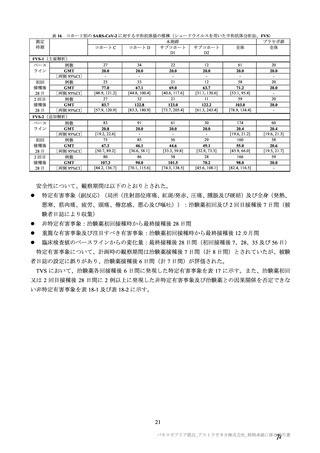
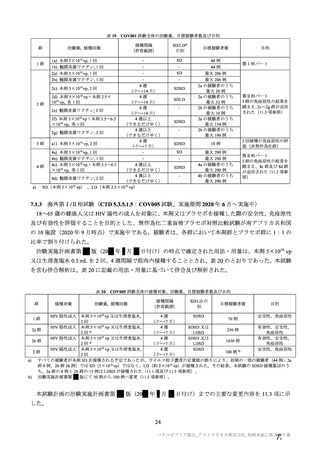
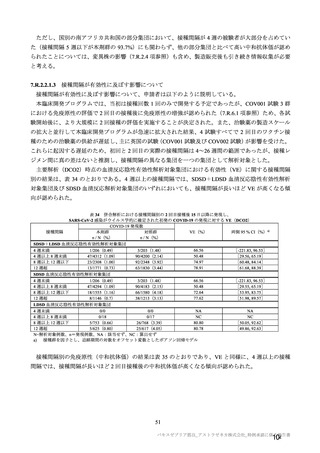
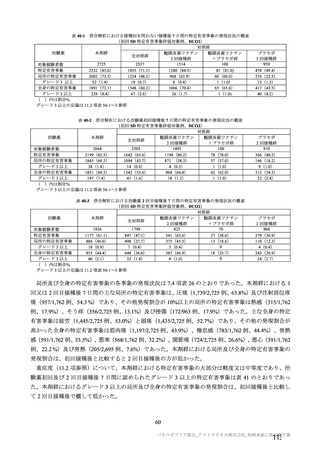
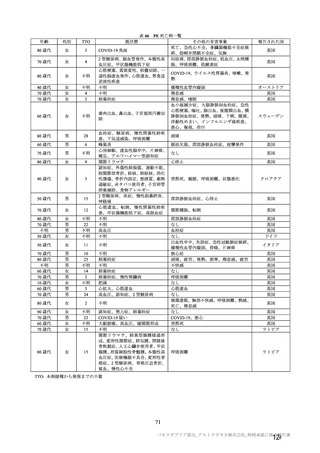
群
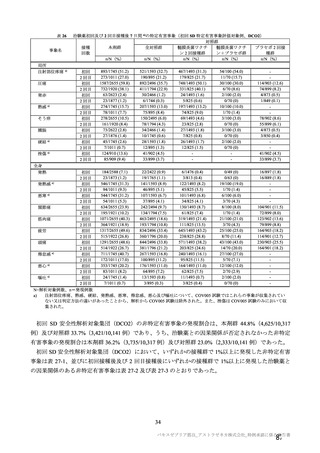
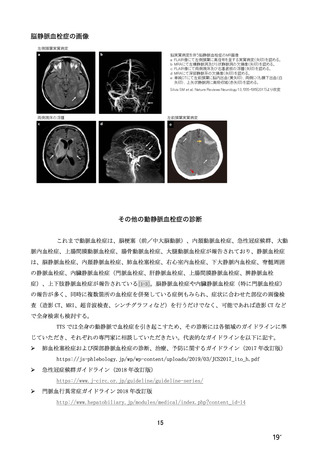
接種対象
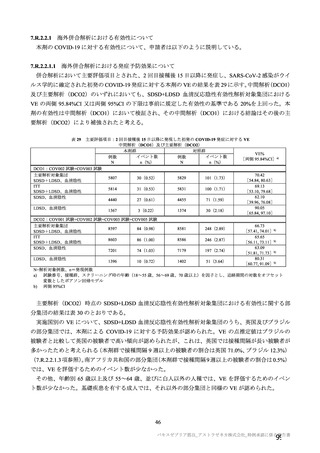
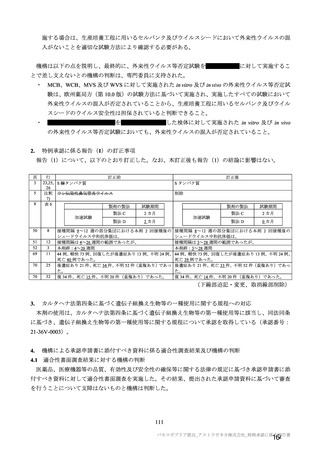
COV002 試験全体の接種対象、治験薬、目標被験者数及び目的
接種間隔
SD/LD の 目標被験者
(許容範
治験薬, 接種回数
別
数
囲)
a1) 本剤 5×1010 vp(Abs 260)a), 1 回
a2) 髄膜炎菌ワクチン, 1 回
a3) 本剤 5×1010 vp(Abs 260)a)+本
剤 3.5~6.5×1010 vp (Abs 260 補正)
b)
, 各1回
1群
56~69 歳の
成人
a4) 髄膜炎菌ワクチン, 2 回
b1) 本剤 5×1010 vp(Abs 260)a)+本
剤 2.2×1010 vp(qPCR)c), 各 1 回
b2) 髄膜炎菌ワクチン, 2 回
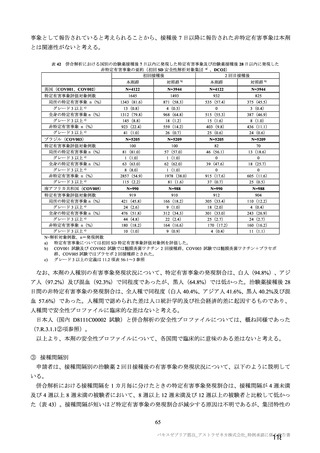
a1) 本剤 5×10 vp(Abs 260) , 1 回
a2) 髄膜炎菌ワクチン, 1 回
a3) 本剤 5×1010 vp(Abs 260)a)+本
剤 3.5~6.5×1010 vp (Abs 260 補正)
b)
, 各1回
10
2群
70 歳以上の
成人
a)
a4) 髄膜炎菌ワクチン, 2 回
b1) 本剤 5×1010 vp(Abs 260)a)+本
剤 2.2×1010 vp(qPCR)c), 各 1 回
b2) 髄膜炎菌ワクチン, 2 回
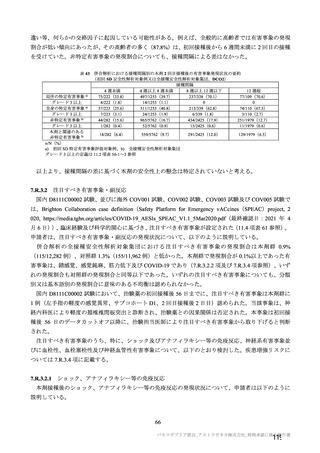
3 群 d)
5~12 歳の
小児
a1) 本剤 2.5×10 vp(qPCR) , 1 回
10
c)
a2) 髄膜炎菌ワクチン, 1 回
LD
LDSD
-
30 例
-
10 例
LD
LDSD
50 例
10 例
a1 の被験者
のうち最大
50 例
a2 の被験者
のうち最大
10 例
-
LDLD
50 例
-
10 例
-
30 例
最大
1775 例
最大
1775 例
a1 の被験者
のうち最大
50 例
a2 の被験者
のうち最大
50 例
a1 の被験者
(ただし b1
を除く)の
うち最大
1725 例
a2 の被験者
(ただし b2
を除く)の
うち最大
1725 例
50 例
50 例
a1 の被験者
のうち最大
50 例
a2 の被験者
のうち最大
50 例
最大 25 例
最大 25 例
最大 25 例
最大 25 例
-
LD
a2) 髄膜炎菌ワクチン, 1 回
-
-
28 日
(+14 日)
LDLD
28 日
(+14 日)
-
4 週以上
LDSD
4 週以上
-
4 週以上
(できるだ
け早く)
4 週以上
(できるだ
け早く)
28 日
(+14 日)
28 日
LD
LDSD
b2) 髄膜炎菌ワクチン, 2 回
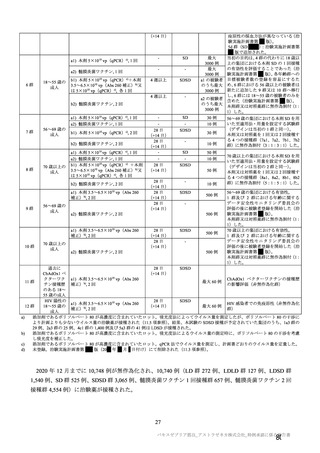
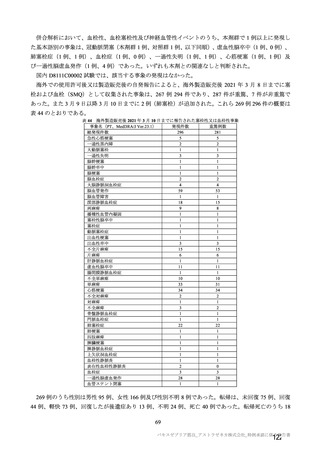
18~55 歳の
成人
c1) 本剤 5×1010 vp(Abs 260)a)+本
剤 3.5~6.5×1010 vp(Abs 260 補正)
b)
又は 5×1010 vp(qPCR)c), 各 1 回
c2) 髄膜炎菌ワクチン, 2 回
a1) 本剤 5×1010 vp(Abs 260)a), 1 回
a2) 髄膜炎菌ワクチン, 1 回
a3) 本剤 5×1010 vp(Abs 260)a)+本
剤 3.5~6.5×1010 vp(Abs 260 補正)
b)
, 各1回
a4) 髄膜炎菌ワクチン, 2 回
5群
18~55 歳の
成人
b1) 本剤 5×1010 vp(qPCR)c), 1 回
b2) 髄膜炎菌ワクチン, 1 回
c1) 本剤 5×1010 vp(qPCR)c), 1 回
c2) 髄膜炎菌ワクチン, 1 回
d1) 本剤 3.5~6.5×1010 vp(Abs 260
補正)b), 2 回
d2) 髄膜炎菌ワクチン, 2 回
30 例
10 例
a1 の被験者
のうち最大
30 例
a2 の被験者
のうち最大
10 例
LDLD
a1) 本剤 5×1010 vp(Abs 260)a), 1 回
b1) 本剤 5×1010 vp(Abs 260)a)+本
剤 2.2×1010 vp(qPCR)c), 各 1 回
4群
4 週以上
(できるだ
け早く)
4 週以上
(できるだ
け早く)
28 日
(+14 日)
28 日
(+14 日)
4 週以上
(できるだ
け早く)
4 週以上
(できるだ
け早く)
28 日
(+14 日)
28 日
(+14 日)
-
-
SD
SD
SDSD
-
30 例
最大 50 例
最大 10 例
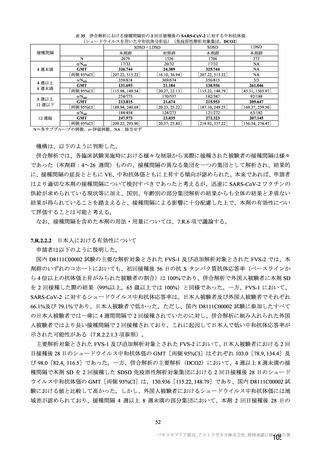
目的
56~69 歳の集団における安全性及び
免疫原性。
当初は本剤又は対照薬を 1 回又は 2 回
接種する 4 つの接種群(1a1、1a2、1b1、
1b2 群)に無作為割付(3:1:3:1)し
た。免疫原性の中間結果を受けて、1 回
接種の接種群に無作為割付けされて
いた被験者は、いずれも 2 回接種の接
種群(1a3、1a4 群)へ移行し、本剤 SD
又は対照薬(移行前の割付けに基づ
く)の 2 回目の接種を受けた(治験実
施計画書第
版)
。
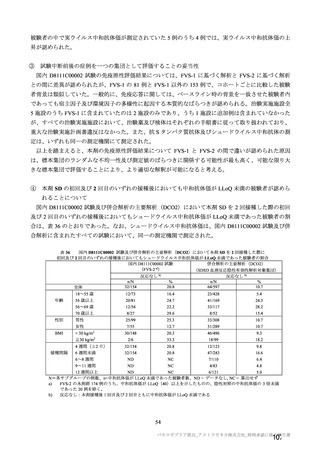
70 歳以上の集団における安全性及び
免疫原性。
当初は本剤又は対照薬を 1 回又は 2 回
接種する 4 つの接種群(2a1、2a2、2b1、
2b2 群)に無作為割付(5:1:5:1)し
た。免疫原性の中間結果を受けて、1 回
接種の接種群に無作為割付けされて
いた被験者は、いずれも 2 回接種の接
種群(2a3、2a4 群)へ移行し、本剤 SD
又は対照薬(移行前の割付けに基づ
く)の 2 回目の接種を受けた(治験実
施計画書第
版)
。
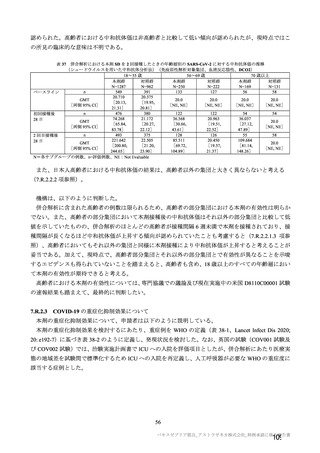
小児での安全性、免疫原性
本剤群又は対照薬群に無作為割付(1:
1)した。
当初の目的は、18 歳以上の集団におけ
る本剤 SD と対照薬の有効性を比較す
ることであった。本試験群が本剤 SD
ではなく本剤 LD を接種していたこと
が判明した後、本試験群への被験者登
録は終了し、本剤 SD の有効性を評価
する新たな試験群(6 群)が追加され
た(治験実施計画書第
版)。
本剤群又は対照薬群に無作為割付(1:
1)した。
COV001 試験の 1 群と同じ来院スケ
ジュールで安全性及び免疫原性につ
いて製剤間の比較を実施する。
5a 群、5b 群及び 5c 群について、本剤
又は対照薬に無作為割付(1:1)した。
5a 群(LD
)
:当初は 5a1 群及び
5a2 群として 1 回接種を予定していた
が、免疫原性の中間結果を受けて、そ
れぞれの被験者は 5a3 群及び 5a4 群へ
移行し、本剤 SD 又は対照薬の 2 回目
の接種を受けた(治験実施計画書第
版)
。
5b 群及び 5c 群(SD
)
:
社による補正された用量の製剤を評
価した(1 回接種のみ)
。5b 群及び 5c
群では、B 細胞又は T 細胞の分析の検
査施設のキャパシティを考慮して、免
26
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
79