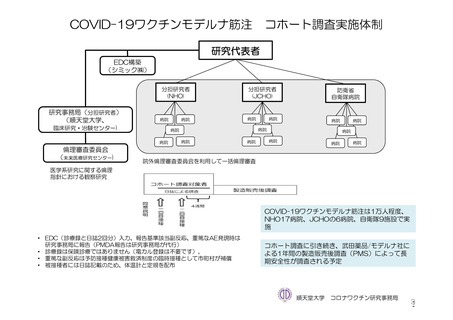
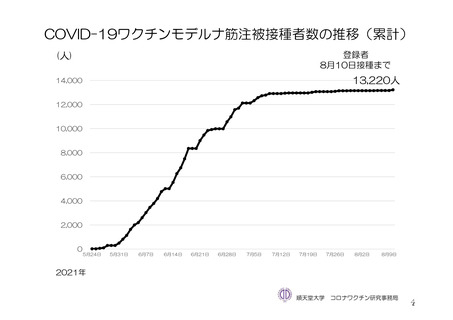
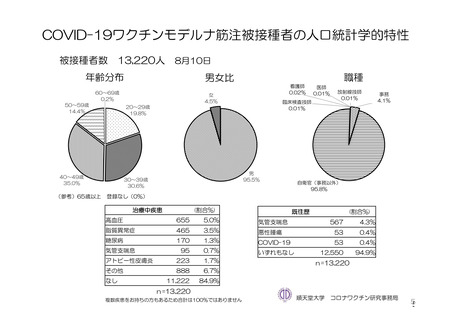
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (156 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
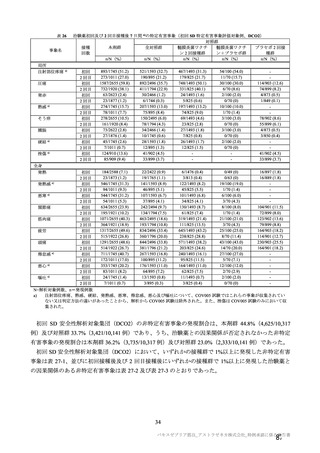
と、その中には重篤な転帰をたどり死亡に至る症例も認められること、海外における動向等を踏まえ、
添付文書の重大な副反応において「血栓症」を注意喚起する必要がある。なお、報告されている血栓症
の中には血小板減少症を伴わない重篤例及び死亡例も報告されていること、本剤接種後に血栓症が発現
するメカニズムは未だ解明されていないこと等を考慮すると、「血小板減少症を伴う血栓症」に限定せ
ず「血栓症」に対して注意喚起することが適切と考える。
一方で、海外製造販売後に報告されている血小板減少症を伴う血栓症については CVST 等の非常にま
れな事象もあり、これらの多くは非高齢者で報告されていること、ヘパリンの使用等の望ましくない治
療方法が明確になってきていることも踏まえ、本剤接種後に血栓症の発現が報告されていること、これ
らの血栓症の内容(発現部位、転帰等)、発現時期(多くは本剤接種から 2 週間以内)、注意すべき症
状、診断や治療に関する情報等について、添付文書又は資材において情報提供する必要がある。
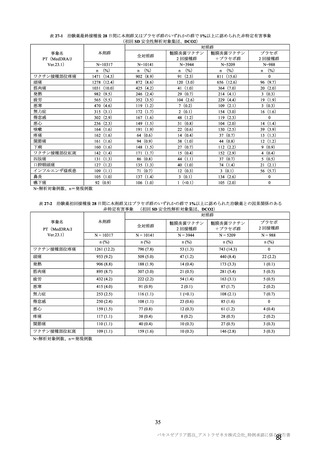
現時点では、海外製造販売後における本剤接種者の背景(性別、年齢等)に偏りがあり、本剤接種後
に認められる血栓症について性別、詳細な年齢層、既往歴等のリスク因子は特定されていないこと、
COVID-19 罹患によるリスクは SARS-CoV-2 流行状況、年齢等によって異なると考えられること等を踏
まえると、定常的な性別、年齢別のリスクについて判断することは困難であると考える。一方で、本剤
については臨床試験等により幅広い年齢層の成人で有効性が認められていることから、SARS-CoV-2 ワ
クチン接種によって得られるベネフィットと上記のリスクのバランスを踏まえると、本剤の承認におい
て性別や年齢の制限を設けることは適切ではなく、SARS-CoV-2 の流行状況等や本剤以外のワクチン接
種等の代替可能な手段に応じて、弾力的に本剤の接種対象を検討することが適当と考える。SARS-CoV2 ワクチンは、「予防接種実施規則」、「新型コロナウイルス感染症に係る臨時の予防接種実施要領」等
に基づき公的ワクチン接種プログラムにおける接種対象を設定することが可能であることから、その中
で本邦における本剤の適切な接種対象について検討できるものと考える。なお、本剤の接種対象を年齢
に基づき制限している国や接種の中断を行っている国においても、本剤の承認又は使用許可の対象を変
更していない。
また、本剤の製造販売後には、申請者が提案する調査、医薬品安全性監視活動等の中で、国内におけ
る本剤接種後の血栓性事象の発現状況や当該事象のリスク因子、本剤接種を避けるべき者の特徴等を検
討する必要があると考える。本剤製造販売後の医薬品安全性監視活動下において、本剤接種との関連性
が疑われる血栓性イベントが報告された際には、当該事象のリスク因子等についての評価を可能とする
情報(患者背景、併用薬、既往歴、検査データ等)を収集し、新たな注意喚起の必要性について検討す
る必要がある。また、上記が可能となるように、関連学会や医療機関との連携についても検討し、情報
収集及び評価に係る体制を整えることが重要である。現在申請者が計画中の一般使用成績調査及び特定
使用成績調査においても血栓性イベントについて検討することは重要と考えるものの、事象の発現率の
低さを踏まえると、これらの調査において新たな知見を見出せる可能性は低いと考えられることから、
別途、既存のデータベース等を用いた観察研究等について、実施可能性も含めて検討する必要がある。
1.3.2
専門協議における安全性に係る議論について
①安全性プロファイルについて
専門協議では、専門委員より以下の意見が出され、報告(1)の「7.R.3.1 安全性プロファイルについ
て」の機構の判断は支持された。
103
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
156