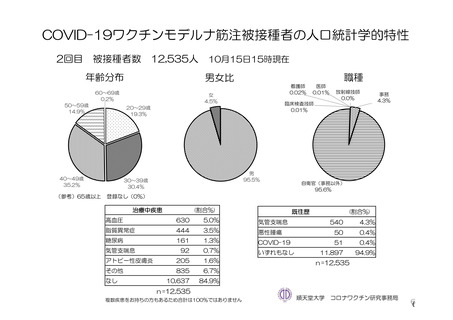
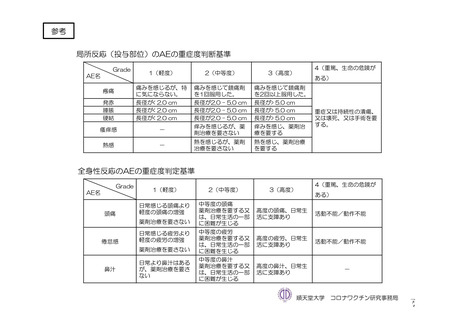
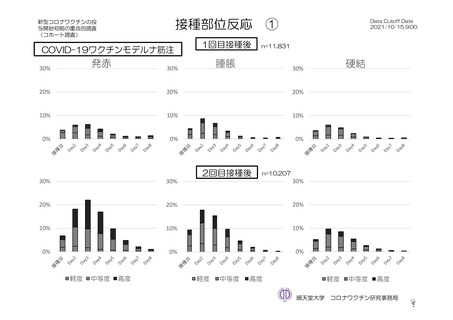
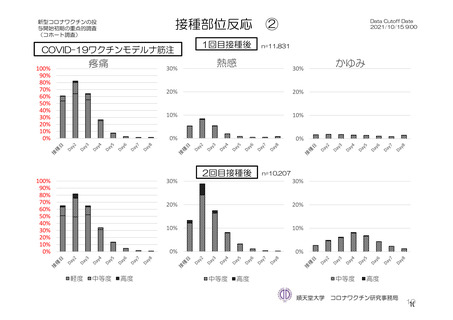
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (76 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
事象名
コホート C
コホート D
サブコホート D1
サブコホート D2
全体
PT
本剤
プラセボ
本剤
プラセボ
本剤
プラセボ
本剤
プラセボ
本剤
プラセボ
(MedDRA/J
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
n (%)
Ver.23.1)
(N=96)
(N=32)
0
圧痛
8(8.3)
0
注射部位疼痛 8(8.3)
筋肉痛
5(5.2)
1(3.1)
疲労
4(4.2)
1(3.1)
0
倦怠感
3(3.1)
0
体温上昇
4(4.2)
0
下痢
2(2.1)
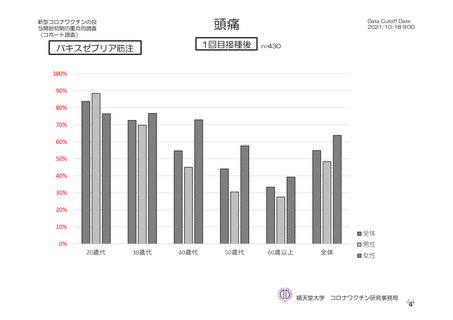
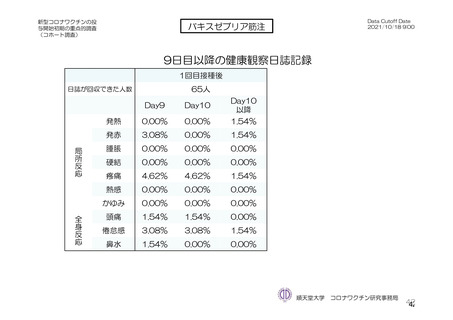
頭痛
2(2.1)
1(3.1)
0
0
注射部位紅斑
N=解析対象例数、n=発現例数
(N=96)
3(3.1)
0
1(1.0)
0
1(1.0)
0
0
0
2(2.1)
(N=32)
0
0
0
2(6.3)
1(3.1)
0
1(3.1)
0
0
(N=65)
2(3.1)
0
1(1.5)
0
1(1.5)
0
0
0
2(3.1)
(N=21)
0
0
0
0
0
0
1(4.8)
0
0
(N=31)
1(3.2)
0
0
0
0
0
0
0
0
(N=11)
0
0
0
2(18.2)
1(9.1)
0
0
0
0
(N=192)
11(5.7)
8(4.2)
6(3.1)
4(2.1)
4(2.1)
4(2.1)
2(1.0)
2(1.0)
2(1.0)
(N=64)
0
0
1(1.6)
3(4.7)
1(1.6)
0
1(1.6)
1(1.6)
0
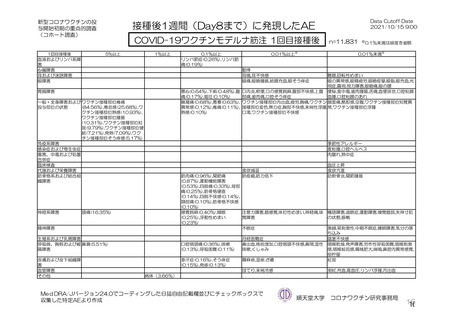
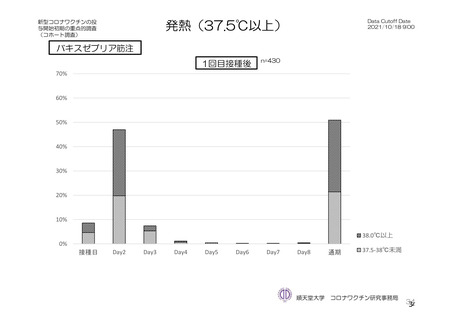
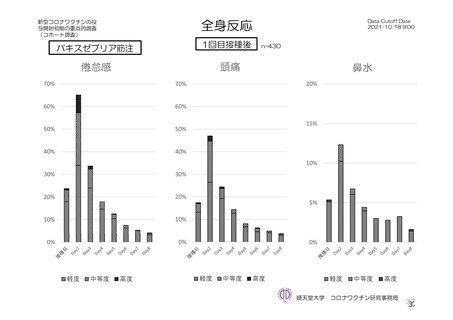
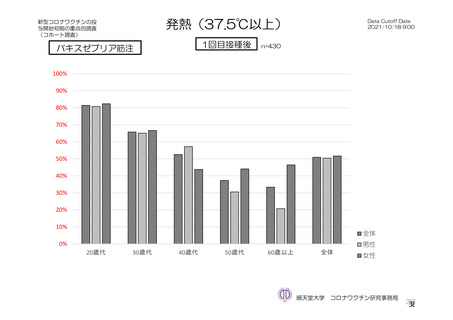
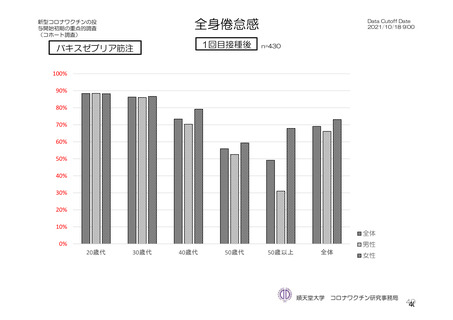
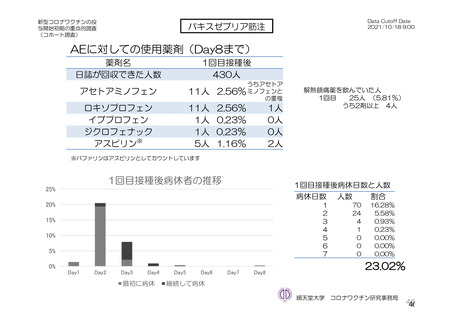
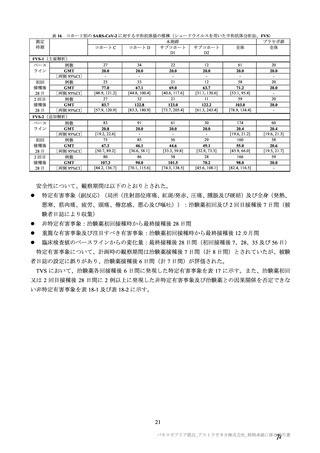
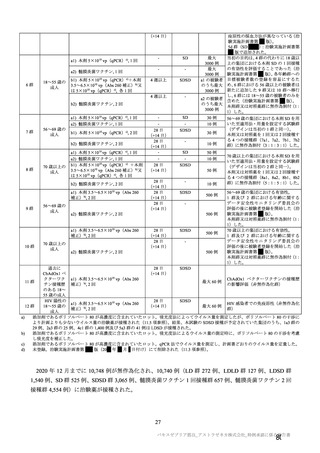
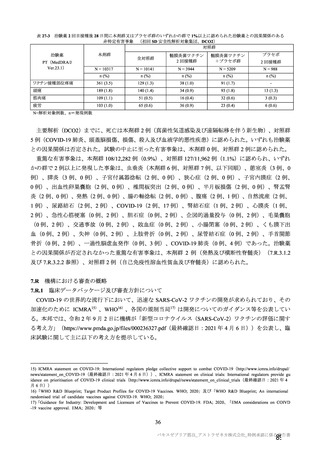
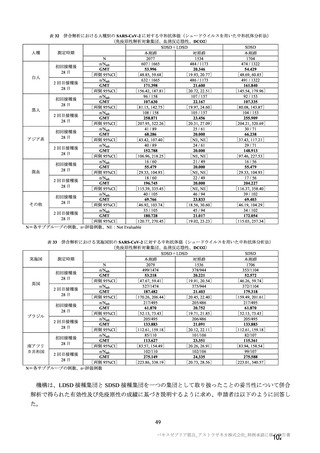
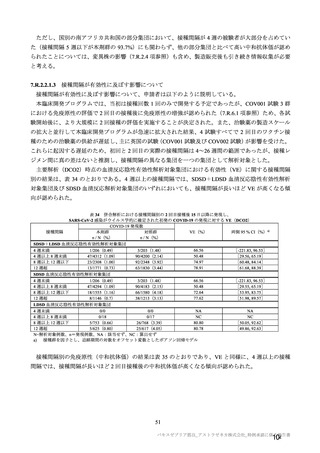
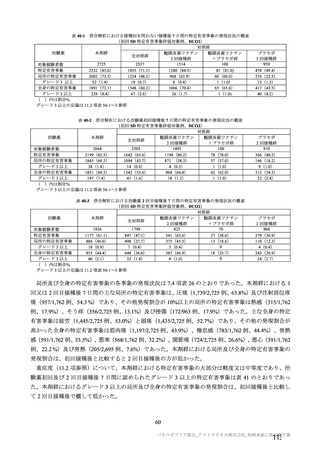
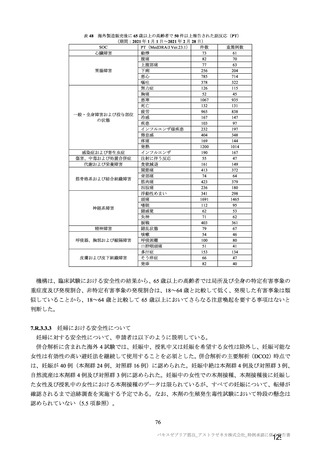
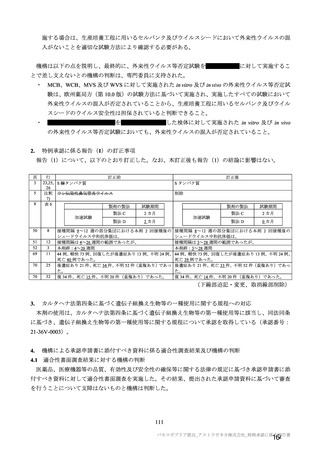
主な非特定有害事象(本剤群又はプラセボ群で発現割合が 5%以上)は、本剤群で圧痛 11 例(5.7%)
であった。最終接種後 28 日までに、死亡及び中止に至った有害事象は認められなかった。重篤な有害事
象はプラセボ群 1 例(子宮頚部上皮異形成)に認められたが、治験薬との因果関係は否定された。
7.1.2
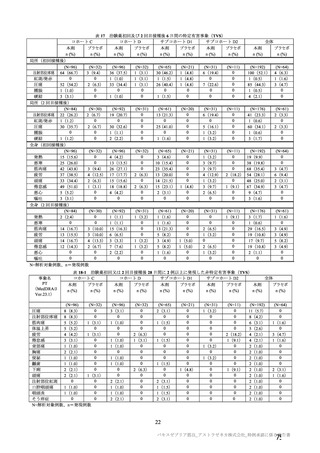
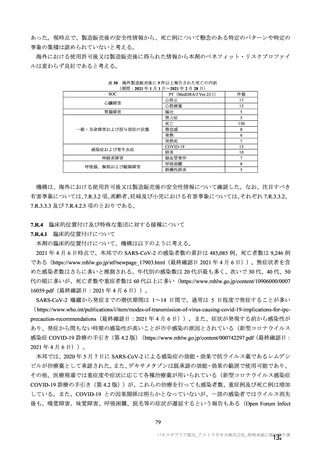
海外第Ⅰ/Ⅱ相試験(CTD 5.3.5.1.2:COV001 試験、実施期間 2020 年 4 月~実施中)
18~55 歳の健康人を対象に、本剤又は髄膜炎菌ワクチンを接種した際の安全性、免疫原性及び有効性
を評価することを目的とした無作為化単盲検比較試験が、英国 7 施設(2020 年 11 月時点)で実施中で
ある。被験者は、3 群を除く各群において本剤群と髄膜炎菌ワクチン群に 1:1 の比率で割り付けられた。
治験実施計画書第
版(20
年
月
日付け)の時点で確定された用法・用量は、本剤 5×1010 vp
を 1 回(SD 群)又は 2 回(SDSD 群)、本剤 5×1010 vp 及び 2.5×1010 vp を各 1 回(SDLD 群)、若しく
は髄膜炎菌ワクチン 0.5 mL を 1 回又は 2 回、筋肉内接種することとされ、表 19 のとおりであった。な
お、4 群の被験者は、治験薬接種後 24 時間にわたり、アセトアミノフェン 1,000 mg/回を 6 時間ごとに
経口投与することが推奨された。本試験を含む併合解析は、表 19 に記載の用法・用量に基づいて併合及
び解析された。
本試験計画の治験実施計画書第
版(20
年
月
日付け)までの主要な変更内容を 11.3 項に
示した。
安全性について、原則としてすべての被験者において被験者日誌を収集し、特定有害事象及び非特定
有害事象を評価することとされた。ただし、2f、2g、4c 及び 4d 群の被験者については、治験薬 2 回目接
種後は被験者日誌を記録しないこととされた。
2020 年 12 月までに 1,067 例が無作為化され、1,067 例(SD 群 116 例、SDSD 群 386 例、SDLD 群 32
例、髄膜炎菌ワクチン 1 回接種群 121 例及び 2 回接種群 412 例)に治験薬が接種された。
2021 年 3 月時点で、本試験は継続中である。開始当初、本試験は独立して評価される計画であったが、
新型コロナウイルスのパンデミックが急速に進みつつある状況において、本剤の有効性をより早期に確
認することを目的として併合解析が計画され(7.R.1.1 項参照)、治験実施計画書第
月
版(20
日付け)及び併合解析の統計解析計画書第
年
月
版(20
年
日付け)の時点で、本試験のデー
タも併合解析に含め、本試験単独の解析は試験終了時に最終解析として実施する計画に変更された。
23
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
76