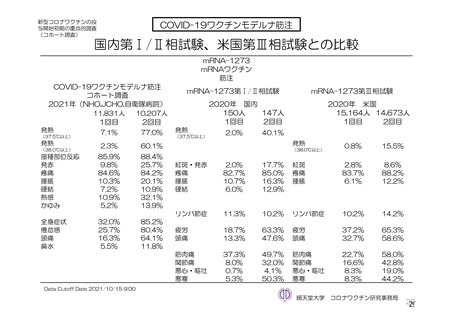
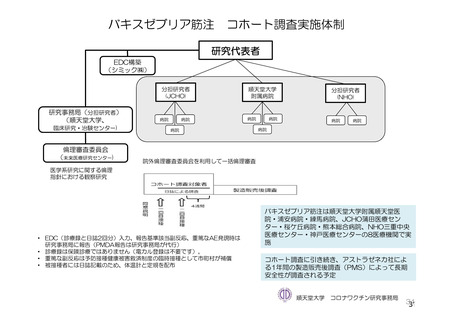
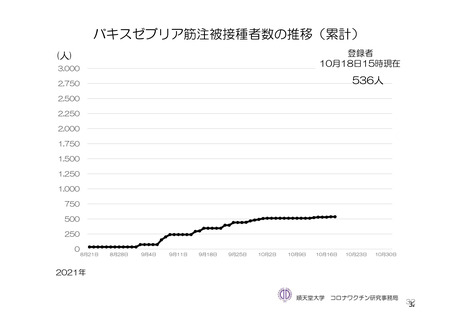
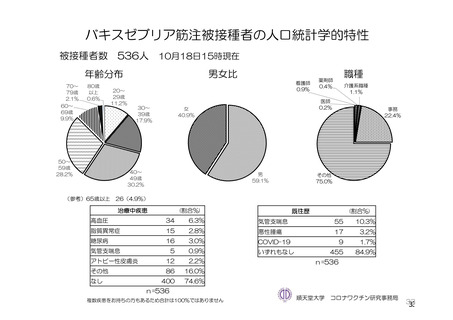
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (74 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
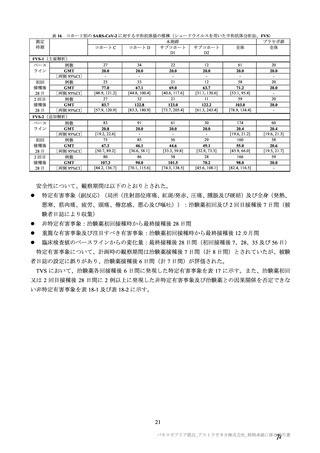
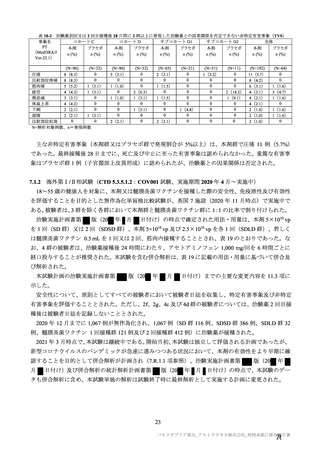
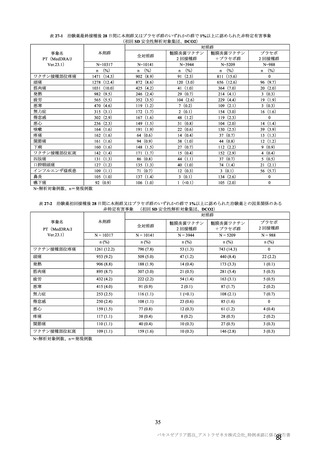
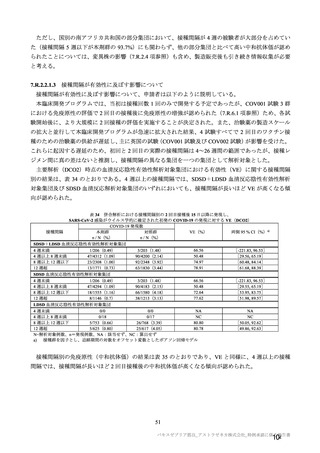
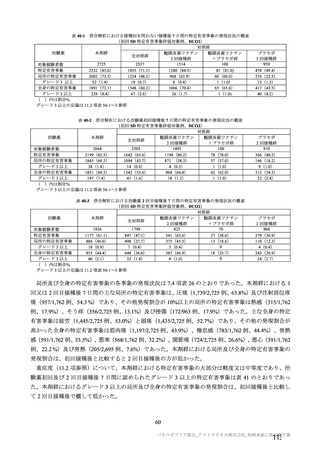
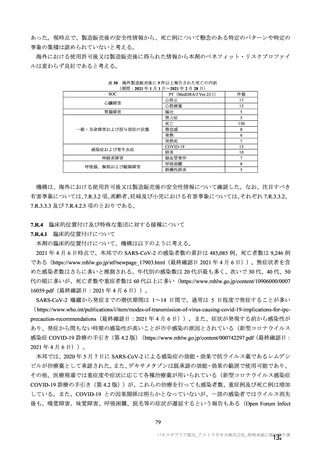
コホート別の SARS-CoV-2 に対する中和抗体価の推移(シュードウイルスを用いた中和抗体分析法、FVS)
本剤群
プラセボ群
コホート C
コホート D
サブコホート
サブコホート
全体
全体
D1
D2
FVS-1(主要解析)
27
34
22
12
61
20
ベース
例数
GMT
20.0
20.0
20.0
20.0
20.0
20.0
ライン
[両側 95%CI]
25
33
21
12
58
20
初回
例数
GMT
77.0
67.1
69.0
63.7
71.2
20.0
接種後
[48.9, 121.2]
[44.8, 100.4]
[40.6, 117.6]
[31.1, 130.6]
[53.1, 95.4]
[両側 95%CI]
28 日
27
32
21
11
59
20
2 回目
例数
GMT
83.7
122.8
123.0
122.2
103.0
20.0
接種後
[57.9, 120.9]
[83.3, 180.9]
[73.7, 205.4]
[61.3, 243.4]
[78.9, 134.4]
[両側 95%CI]
28 日
測定
時期
FVS-2(追加解析)
ベース
例数
GMT
ライン
[両側 95%CI]
初回
例数
GMT
接種後
[両側 95%CI]
28 日
2 回目
例数
GMT
接種後
[両側 95%CI]
28 日
83
20.8
[19.2, 22.6]
75
67.3
[50.7, 89.2]
80
107.3
[84.2, 136.7]
91
20.0
85
46.1
[36.6, 58.1]
86
90.0
[70.1, 115.6]
61
20.0
56
44.6
[33.3, 59.8]
58
101.5
[74.3, 138.5]
30
20.0
29
49.1
[32.9, 73.3]
28
70.2
[45.6, 108.1]
174
20.4
[19.6, 21.2]
160
55.0
[45.9, 66.0]
166
98.0
[82.4, 116.5]
60
20.4
[19.6, 21.3]
58
20.6
[19.5, 21.7]
59
20.0
-
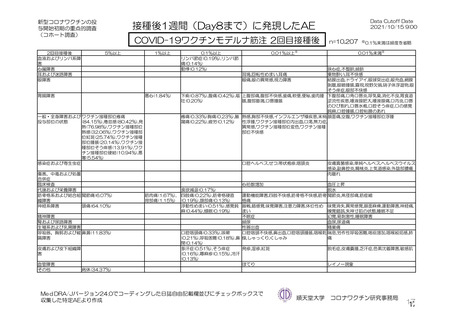
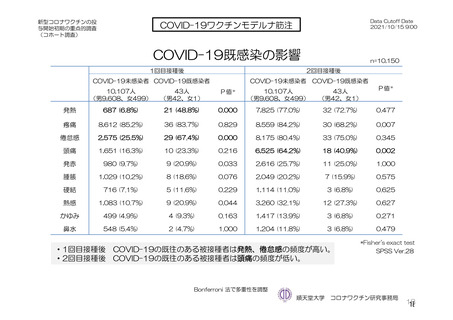
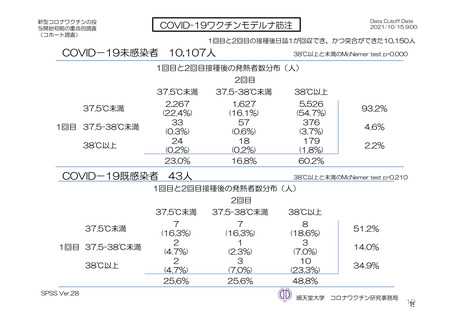
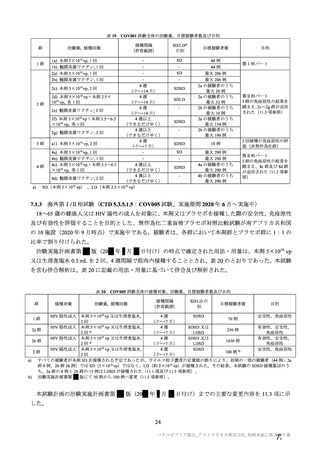
安全性について、観察期間は以下のとおりとされた。
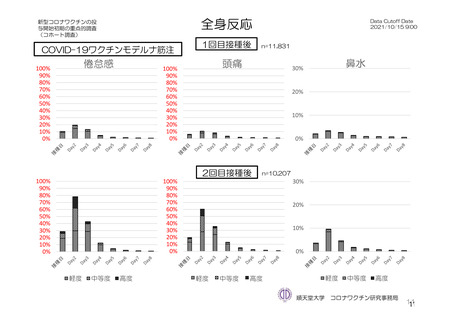
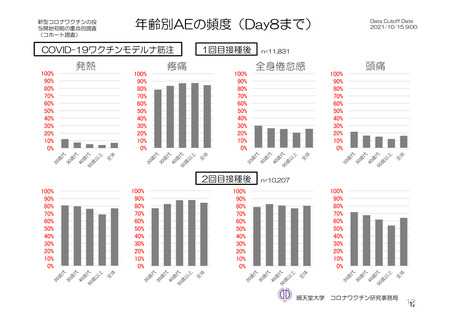
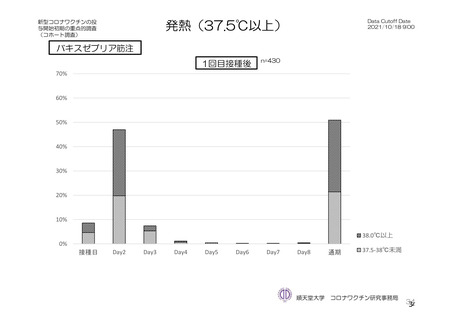
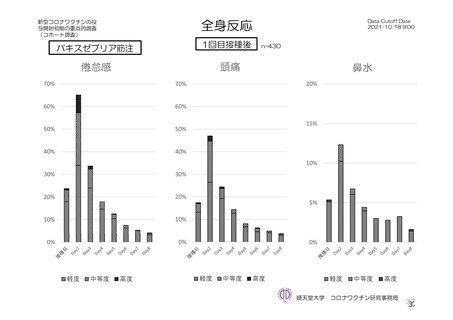
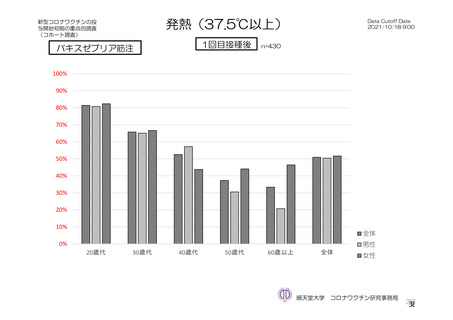
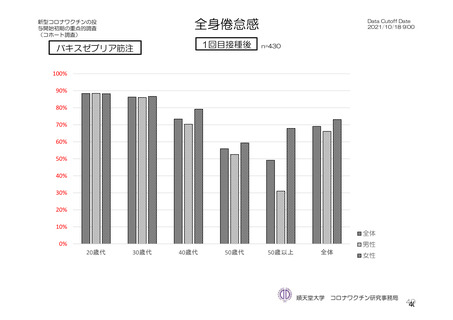
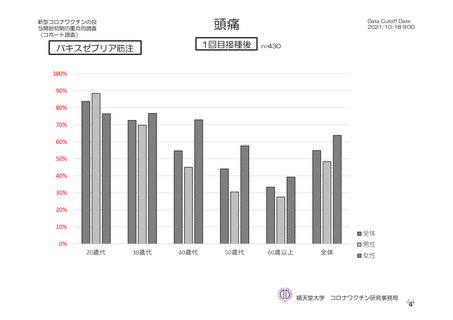
特定有害事象(副反応)(局所(注射部位疼痛、紅斑/発赤、圧痛、腫脹及び硬結)及び全身(発熱、
悪寒、筋肉痛、疲労、頭痛、倦怠感、悪心及び嘔吐)):治験薬初回及び 2 回目接種後 7 日間(被
験者日誌により収集)
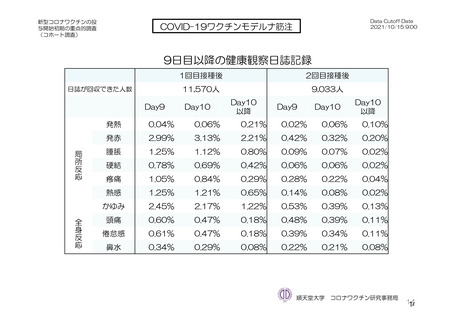
非特定有害事象:治験薬初回接種時から最終接種後 28 日間
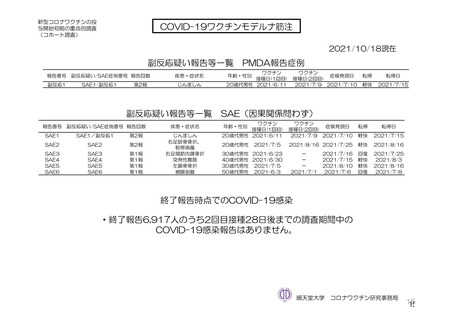
重篤な有害事象及び注目すべき有害事象:治験薬初回接種時から最終接種後 12 カ月間
臨床検査値のベースラインからの変化量:最終接種後 28 日間(初回接種後 7、28、35 及び 56 日)
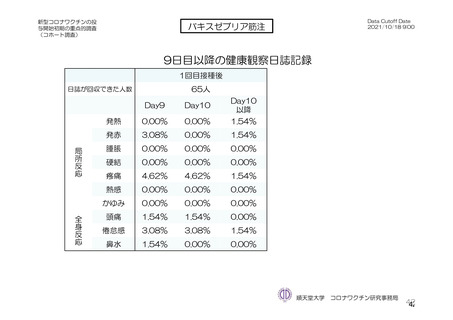
特定有害事象について、計画時の観察期間は治験薬接種後 7 日間(計 8 日間)とされていたが、被験
者日誌の設定に誤りがあり、治験薬接種後 6 日間(計 7 日間)が評価された。
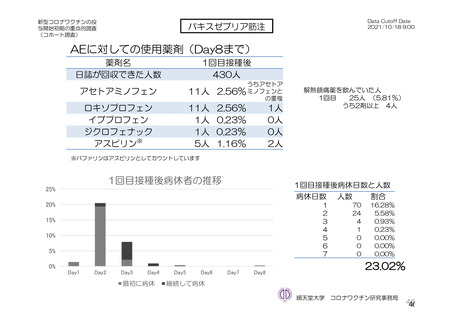
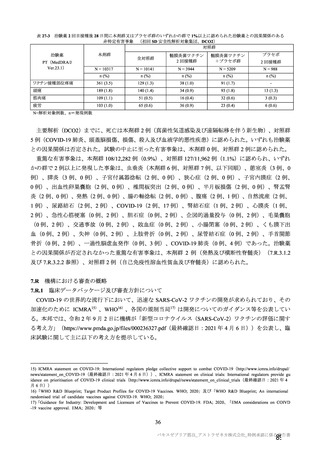
TVS において、治験薬各回接種後 6 日間に発現した特定有害事象を表 17 に示す。また、治験薬初回
又は 2 回目接種後 28 日間に 2 例以上に発現した非特定有害事象及び治験薬との因果関係を否定できな
い非特定有害事象を表 18-1 及び表 18-2 に示す。
21
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
74