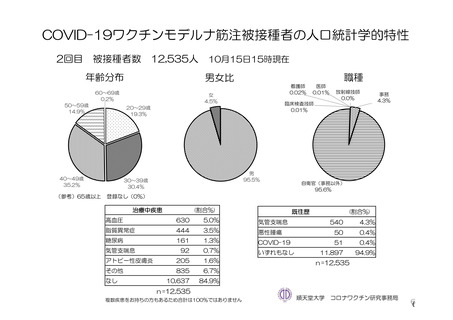
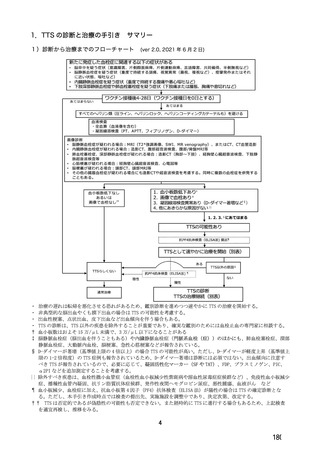
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (87 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
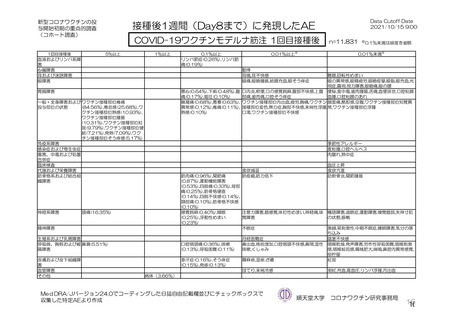
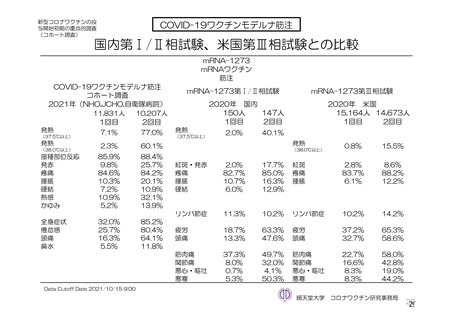
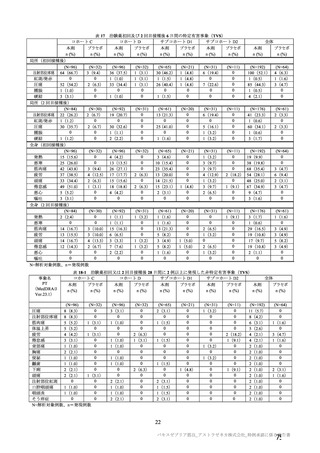
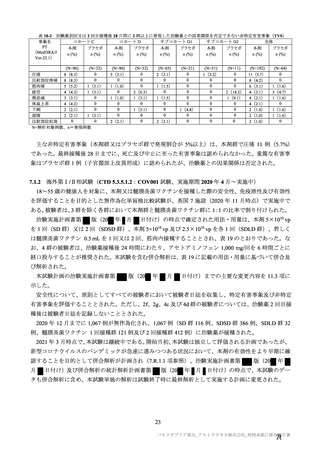
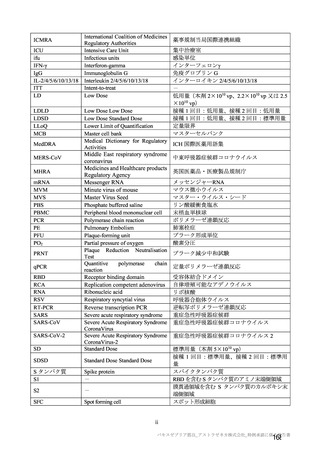
事象名
局所
注射部位疼痛
圧痛
発赤
熱感 a)
そう痒
腫脹
硬結 a)
挫傷 a)
a)
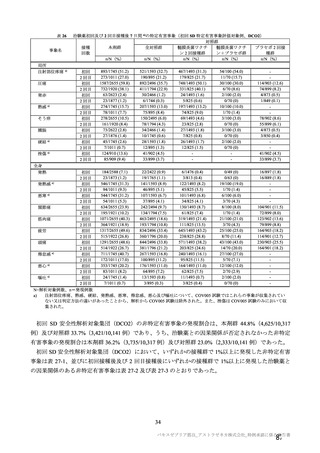
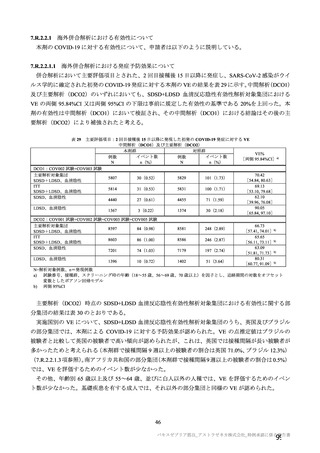
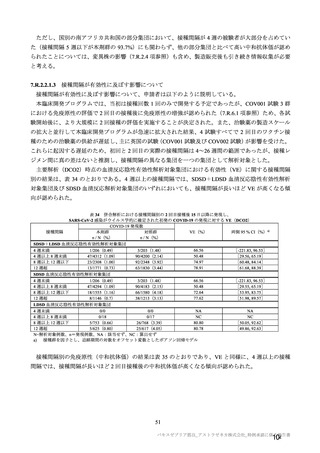
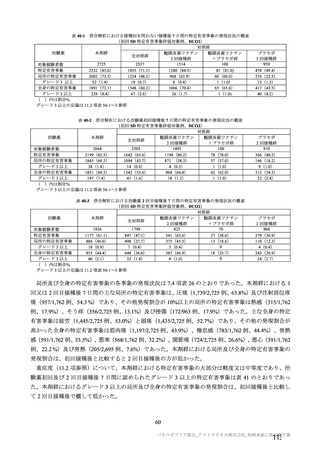
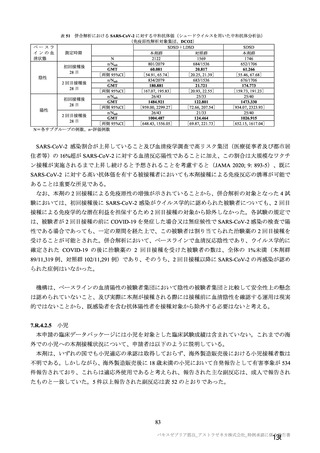
治験薬初回及び 2 回目接種後 7 日間 a)の特定有害事象(初回 SD 特定有害事象評価対象例、DCO2)
対照群
本剤群
全対照群
髄膜炎菌ワクチ
髄膜炎菌ワクチ
プラセボ 2 回接
接種
ン 2 回接種群
ン+プラセボ群
種群
回数
n/N(%)
n/N(%)
n/N(%)
n/N(%)
n/N(%)
初回
2 回目
初回
2 回目
初回
2 回目
初回
2 回目
初回
2 回目
初回
2 回目
初回
2 回目
初回
2 回目
893/1745 (51.2)
273/1011 (27.0)
1587/2655 (59.8)
732/1920 (38.1)
63/2623 (2.4)
23/1877 (1.2)
274/1745 (15.7)
78/1011 (7.7)
278/2655 (10.5)
161/1920 (8.4)
73/2622 (2.8)
27/1876 (1.4)
45/1745 (2.6)
7/1011 (0.7)
124/910 (13.6)
85/909 (9.4)
521/1593 (32.7)
190/895 (21.2)
892/2496 (35.7)
411/1794 (22.9)
30/2466 (1.2)
6/1744 (0.3)
207/1593 (13.0)
75/895 (8.4)
150/2495 (6.0)
78/1794 (4.3)
34/2466 (1.4)
10/1745 (0.6)
28/1593 (1.8)
12/895 (1.3)
41/902 (4.5)
33/899 (3.7)
467/1493 (31.3)
179/825 (21.7)
748/1493 (50.1)
331/825 (40.1)
24/1493 (1.6)
5/825 (0.6)
197/1493 (13.2)
74/825 (9.0)
69/1493 (4.6)
23/825 (2.8)
27/1493 (1.8)
7/825 (0.8)
26/1493 (1.7)
12/825 (1.5)
-
54/100 (54.0)
11/70 (15.7)
30/100 (30.0)
6/70 (8.6)
2/100 (2.0)
0/70 (0)
10/100 (10.0)
1/70 (1.4)
3/100 (3.0)
0/70 (0)
3/100 (3.0)
0/70 (0)
2/100 (2.0)
0/70 (0)
-
114/903 (12.6)
74/899 (8.2)
4/873 (0.5)
1/849 (0.1)
78/902 (8.6)
55/899 (6.1)
4/873 (0.5)
3/850 (0.4)
41/902 (4.5)
33/899 (3.7)
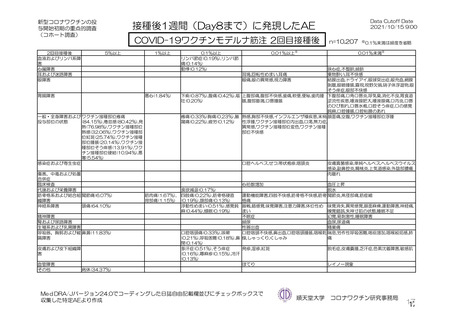
全身
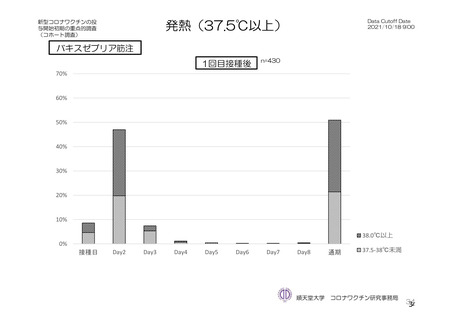
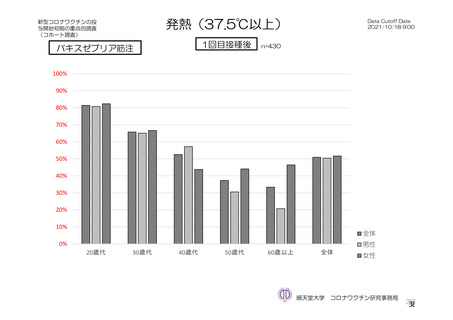
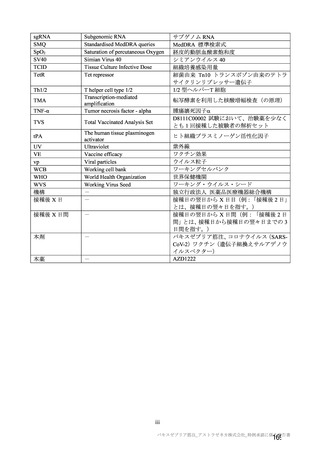
発熱
184/2588 (7.1)
22/2422 (0.9)
6/1476 (0.4)
0/49 (0)
16/897 (1.8)
初回
23/1873 (1.2)
19/1765 (1.1)
3/813 (0.4)
0/63 (0)
16/889 (1.8)
2 回目
546/1745 (31.3)
141/1593 (8.9)
122/1493 (8.2)
19/100 (19.0)
発熱感 a)
初回
94/1011 (9.3)
46/895 (5.1)
45/825 (5.5)
1/70 (1.4)
2 回目
544/1745 (31.2)
107/1593 (6.7)
101/1493 (6.8)
6/100 (6.0)
悪寒 a)
初回
54/1011 (5.3)
37/895 (4.1)
34/825 (4.1)
3/70 (4.3)
2 回目
634/2655 (23.9)
242/2494 (9.7)
130/1493 (8.7)
8/100 (8.0)
104/901 (11.5)
関節痛
初回
195/1921 (10.2)
134/1794 (7.5)
61/825 (7.4)
1/70 (1.4)
72/899 (8.0)
2 回目
1071/2655 (40.3)
463/2495 (18.6)
319/1493 (21.4)
21/100 (21.0)
123/902 (13.6)
筋肉痛
初回
364/1921 (18.9)
193/1794 (10.8)
111/825 (13.5)
3/70 (4.3)
79/899 (8.8)
2 回目
1317/2655 (49.6)
834/2496 (33.4)
645/1493 (43.2)
25/100 (25.0)
164/903 (18.2)
疲労
初回
515/1922 (26.8)
360/1796 (20.0)
238/825 (28.8)
8/70 (11.4)
114/901 (12.7)
2 回目
1291/2655 (48.6)
844/2496 (33.8)
571/1493 (38.2)
43/100 (43.0)
230/903 (25.5)
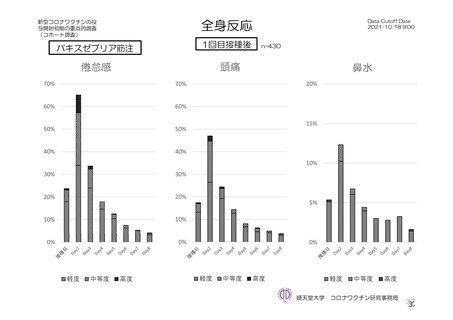
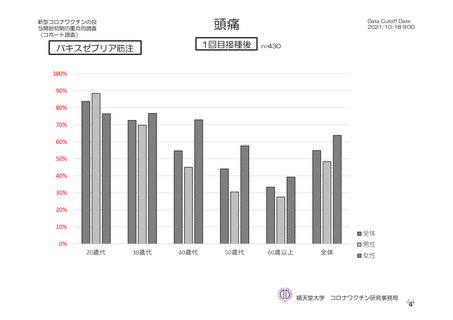
頭痛
初回
514/1922 (26.7)
381/1796 (21.2)
203/825 (24.6)
14/70 (20.0)
164/901 (18.2)
2 回目
711/1745 (40.7)
267/1593 (16.8)
240/1493 (16.1)
27/100 (27.0)
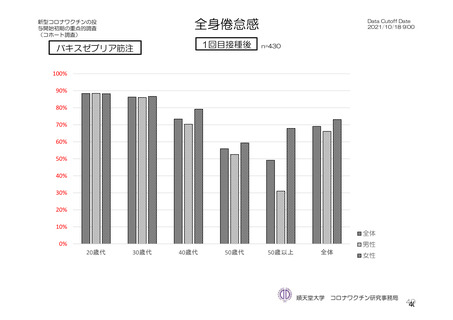
倦怠感 a)
初回
172/1011 (17.0)
100/895 (11.2)
95/825 (11.5)
5/70 (7.1)
2 回目
353/1745 (20.2)
176/1593 (11.0)
164/1493 (11.0)
12/100 (12.0)
悪心 a)
初回
83/1011 (8.2)
64/895 (7.2)
62/825 (7.5)
2/70 (2.9)
2 回目
24/1745 (1.4)
13/1593 (0.8)
11/1493 (0.7)
2/100 (2.0)
嘔吐 a)
初回
7/1011 (0.7)
3/895 (0.3)
3/825 (0.4)
0/70 (0)
2 回目
N=解析対象例数、n=発現例数
a)
注射部位疼痛、熱感、硬結、発熱感、悪寒、倦怠感、悪心及び嘔吐について、COV005 試験ではこれらの事象が収集されてい
ない又は判定方法の違いがあったことから、解析から COV005 試験は除外された。また、挫傷は COV005 試験のみにおいて収
集された。
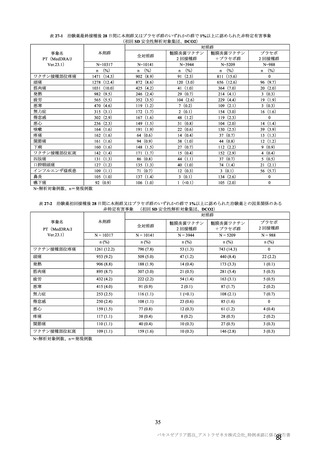
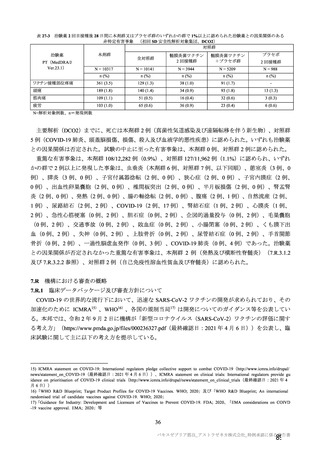
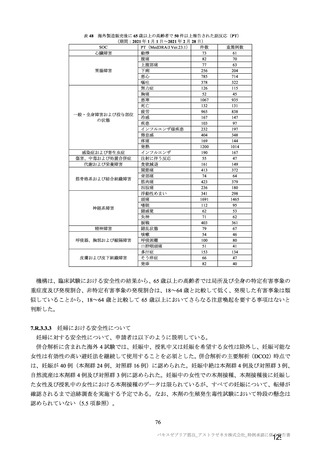
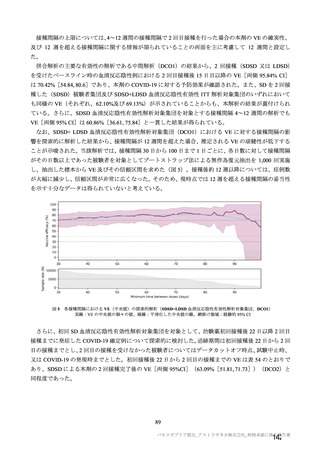
初回 SD 安全性解析対象集団(DCO2)の非特定有害事象の発現割合は、本剤群 44.8%(4,625/10,317
例)及び対照群 33.7%(3,421/10,141 例)であり、うち、治験薬との因果関係が否定されなかった非特定
有害事象の発現割合は本剤群 36.2%(3,735/10,317 例)及び対照群 23.0%(2,333/10,141 例)であった。
初回 SD 安全性解析対象集団(DCO2)において、いずれかの接種群で 1%以上に発現した非特定有害
事象は表 27-1、並びに初回接種後及び 2 回目接種後にいずれかの接種群で 1%以上に発現した治験薬と
の因果関係のある非特定有害事象は表 27-2 及び表 27-3 のとおりであった。
34
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
87