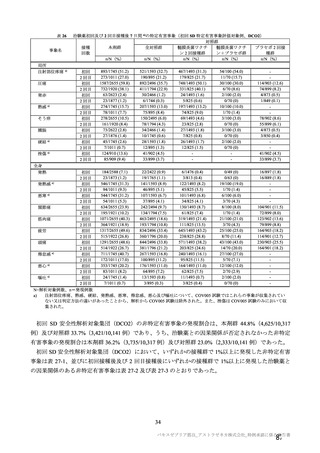
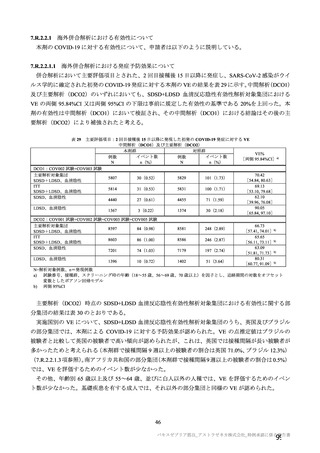
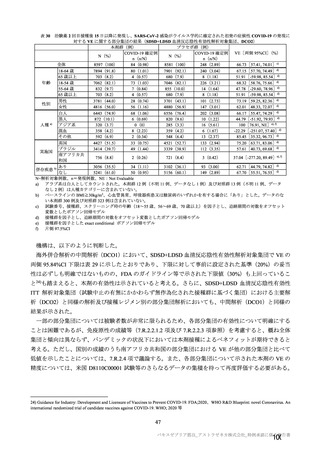
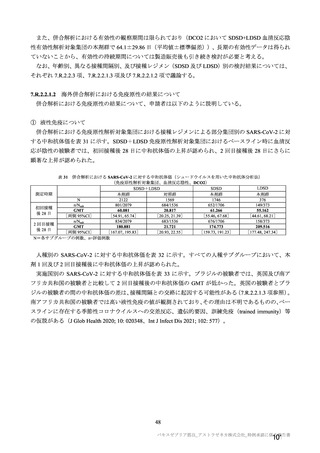
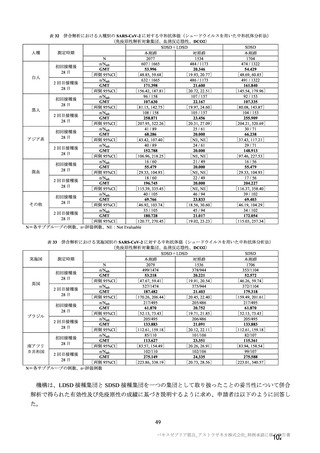
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (121 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
神経系有害事象
本剤接種後の神経系有害事象の発現状況について、申請者は以下のように説明している。
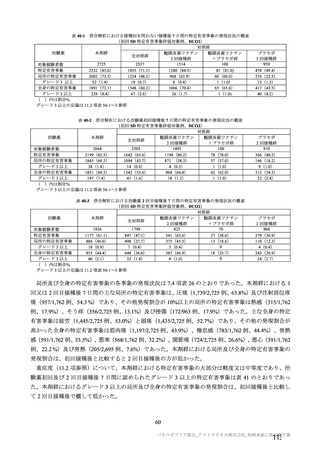
併合解析において、神経系有害事象及び免疫介在性の可能性がある神経学的兆候のうち、本剤群で 5
例以上に発現した基本語別の事象は、錯感覚(本剤群 0.3%(42 例)、対照群 0.4%(51 例)、以下同順)、
感覚鈍麻(0.1%(15 例)、0.2%(20 例))、筋力低下(0.1%(7 例)、0.1%(9 例))であった。
重篤な事象として報告された免疫介在性の可能性がある神経学的兆候が本剤群で 2 例(横断性脊髄炎
及び多発性硬化症)、対照(髄膜炎菌ワクチン)群で 1 例(脊髄炎)認められた。横断性脊髄炎及び脊
髄炎は軽快し、多発性硬化症については回復が認められた。本剤群の横断性脊髄炎及び対照群の脊髄炎
については因果関係が否定されず、多発性硬化症は因果関係なしとされた。
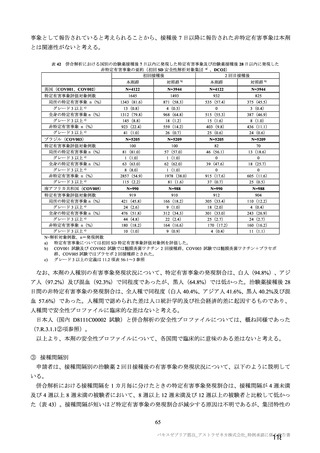
本剤群で 4 例、対照群で 3 例に顔面神経麻痺が認められた。いずれも非重篤な事象で、本剤群の 3 例
は初回接種後(約 3 カ月、約 80 日、2 日)、1 例は 2 回目接種後 21 日(初回接種後 51 日)に発現した。
いずれもステロイド治療により転帰は 1 例回復、3 例軽快であった。
また、本剤群で重篤な第 6 神経麻痺(外転神経麻痺)が、2 回目接種後約 3 カ月に認められ、転帰は
未回復で、本剤との因果関係はないと判断された。
国内 D8111C00002 試験では、上述のとおり本剤群 1 例に左手指の軽度の感覚異常が発現したが、頚椎
椎間板突出の症状であると診断され、本剤との因果関係は否定された。本事象は初回接種後 56 日のデー
タカットオフ以降に、治験担当医師により注目すべき有害事象から取り下げると判断された。
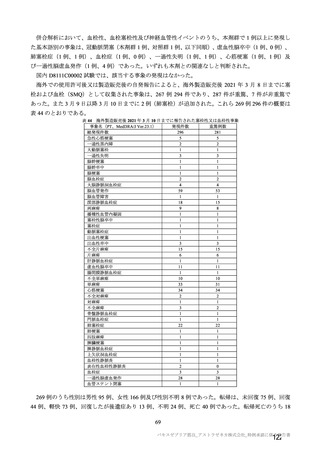
海外での使用許可後又は製造販売後の自発報告(報告期間:2021/1/1~2021/2/28)に基づくと、免疫介
在性神経学的事象は 101 件報告されており、うち 86 件が重篤例であった。PT 基本語による内訳は、神
経痛 54 件、多発性硬化症及び末梢性ニューロパチー各 8 件、ギラン・バレー症候群及び感覚消失各 6
件、感覚障害 5 件、多発性硬化症再発及び横断性脊髄炎各 4 件、視神経炎 3 件、脳炎、脳症及び末梢性
感覚運動ニューロパチー各 1 件であり、このうち重篤例は神経痛 48 件、末梢性ニューロパチー7 件、ギ
ラン・バレー症候群 6 件、多発性硬化症 5 件、多発性硬化症再発 4 件、横断性脊髄炎及び感覚消失各 4
件、感覚障害 3 件、視神経炎 2 件、脳炎、脳症及び末梢性感覚運動ニューロパチー各 1 件であった。ま
た、これら以外の神経系障害として PT 基本語で痙攣発作 77 件、顔面麻痺 39 件、てんかん 15 件、顔面
不全麻痺 9 件、全身性強直性間代性発作 5 件、強直性痙攣 3 件、ナルコレプシー2 件、熱性痙攣 2 件、
てんかん重積状態 2 件、間代性痙攣 1 件が認められ、顔面麻痺 6 件、顔面不全麻痺 2 件及びてんかん 1
件を除き重篤例であった。
神経学的事象に含まれる多くの事象の発現件数は文献等に基づく背景発現率から予測された件数より
少なく、神経学的症状と本剤との関連性は確立されていないものの、併合解析において本剤接種後に重
篤な脱髄関連事象が報告されていること等を踏まえ、添付文書等において注意喚起を行うとともに、免
疫介在性の神経学的反応を RMP において重要な潜在的リスクに設定する。
機構は、神経系有害事象について、申請者の説明を了承した。ただし、臨床試験及び海外製造販売後
に本剤接種後に重篤な脱髄関連事象等の神経系有害事象が発現していることについては、添付文書及び
資材等において情報提供する必要があると考える。
7.R.3.2.3
血栓性、血栓塞栓性及び神経血管性イベント
本剤接種後の血栓性、血栓塞栓性及び神経血管性イベントの発現状況について、申請者は以下のよう
に説明している。
68
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
121