参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (84 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
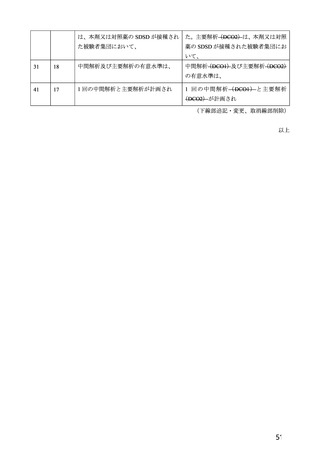
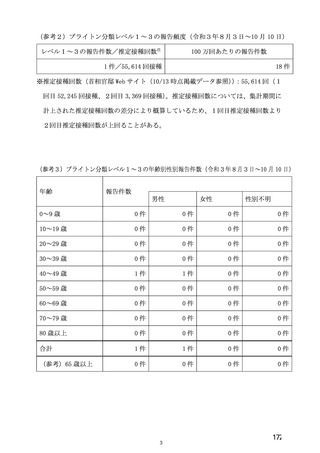
の COVID-19 イベント発現率))とされ、RT-PCR 又はその他の核酸増幅検査が陽性となった検体の採
取日及び COVID-19 症状の発現日がいずれも 2 回目の接種後 15 日以降であった症例のみがイベントと
して集計された。併合された 4 試験すべてにおいて、SARS-CoV-2 感染がウイルス学的に確定された全
被験者に対して、盲検化された独立かつ同一のエンドポイント判定委員会による COVID-19 イベントの
判定が実施された。VE の解析では、有効性に関する基準として、0%を大きく上回るとの観点から 20%
が設定され、信頼区間の下限との比較で評価することとされた。
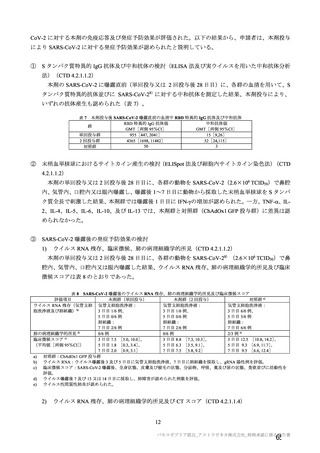
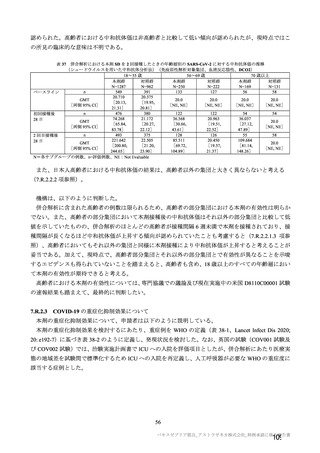
COVID-19 パンデミック下での公衆衛生上の緊急事態における迅速な意思決定を目的として、本剤又
は対照薬の SDSD が接種された被験者集団において、有効性主要評価項目とされた COVID-19 イベント
が 53 件観察された時点での 1 回の中間解析(DCO1)が計画された。なお、この場合の検出力は、VE を
70%と仮定し、有意水準を両側 1.13%、閾値を 20%とすると 77%であるとされた。また、高齢者等の部
分集団における本剤の予防効果の推定や有効性の持続期間の推定のためにさらなる追跡を行い、より多
くの症例を集積するためとの理由から、中間解析(DCO1)で本剤の有効性が検証された場合であっても
各試験を継続し、主要解析(DCO2)を実施する計画とされた。主要解析(DCO2)は、本剤又は対照薬
の SDSD が接種された被験者集団において、105 件の COVID-19 イベントが観察された時点で実施する
こととされた。なお、この場合の検出力は、VE を 60%と仮定し、有意水準を両側 4.44%、閾値を 20%と
すると 90%であるとされた。中間解析の実施に伴う第一種の過誤確率の制御には、ガンマ α 消費関数が
用いられ、中間解析(DCO1)及び主要解析(DCO2)の有意水準は、それぞれ両側 1.13%及び 4.44%と
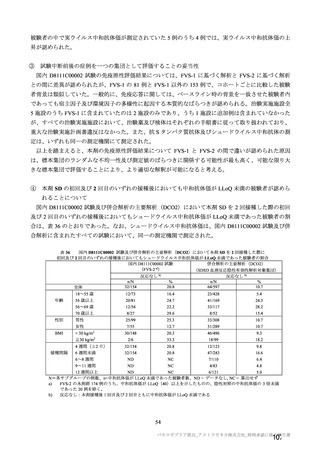
された。しかしながら、中間解析(DCO1)のためのデータカットオフ前に発症例が急速に蓄積されたた
めに SDSD 接種集団として 98 件の COVID-19 イベントが中間解析(DCO1)に含まれることとなり(SDSD
及び LDSD 接種集団としては 131 件)、ガンマ α 消費関数(γ= -2.5)により中間解析(DCO1)の有意水
準は両側 4.16%とされた。
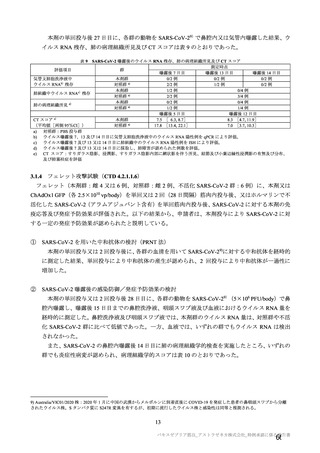
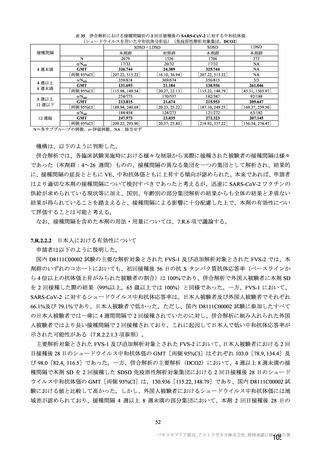
中間解析(DCO1)時点における 2 回目接種後 15 日以降の追跡期間14)(平均値±標準偏差)は、初回
SD 安全性解析対象集団では本剤群 52.1±24.18 日及び対照群 51.3±22.91 日、SDSD+LDSD 血清反応陰
性有効性解析対象集団では本剤群 42.9±18.12 日及び対照群 42.9±17.91 日であった。主要解析(DCO2)
時点における 2 回目接種後 15 日以降の追跡期間(平均値±標準偏差)は、初回 SD 安全性解析対象集団
では本剤群 68.9±35.75 日及び対照群 68.2±34.87 日、SDSD+LDSD 血清反応陰性有効性解析対象集団で
は本剤群 64.1±29.86 日及び対照群 64.0±29.49 日であった。
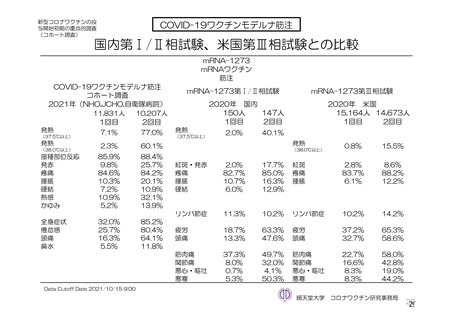
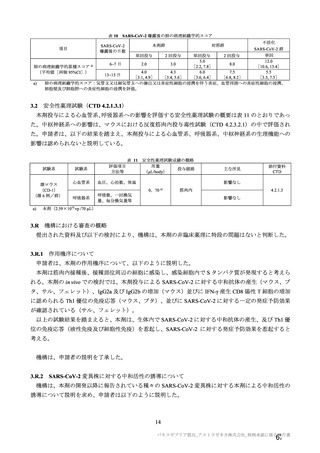
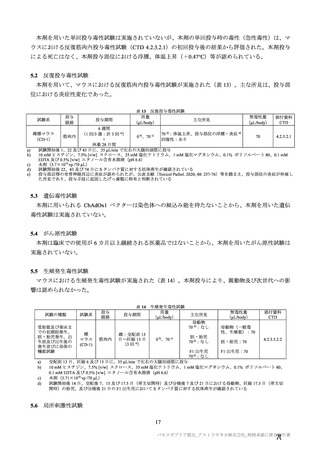
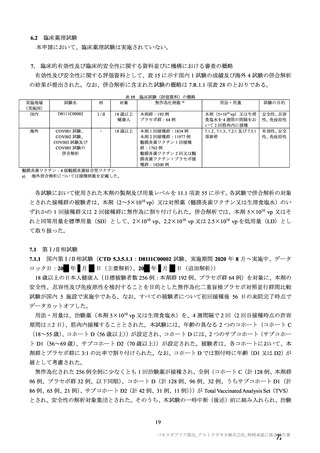
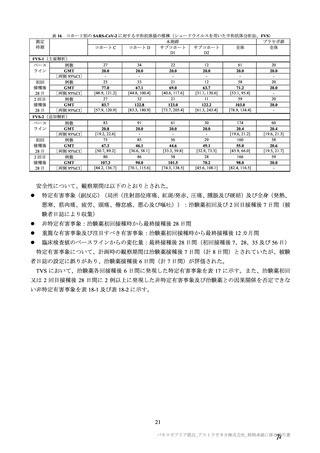
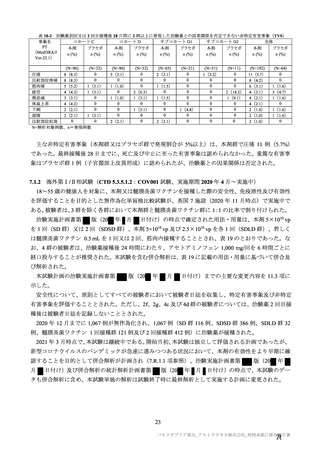
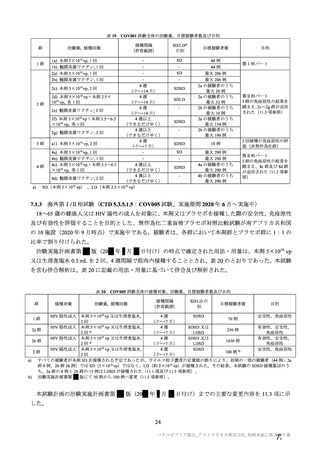
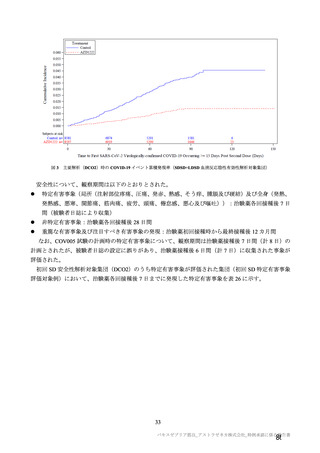
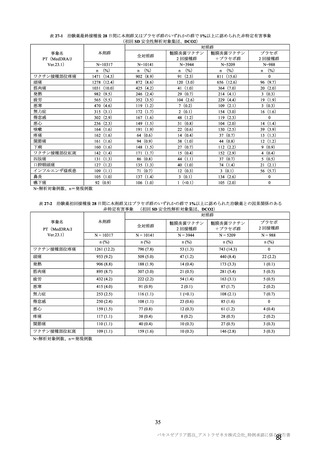
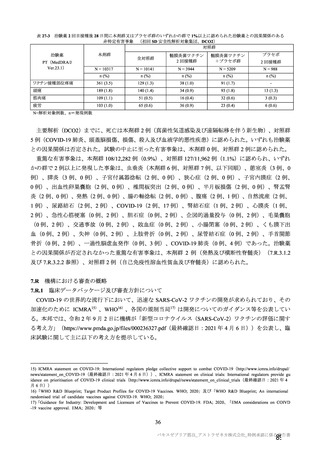
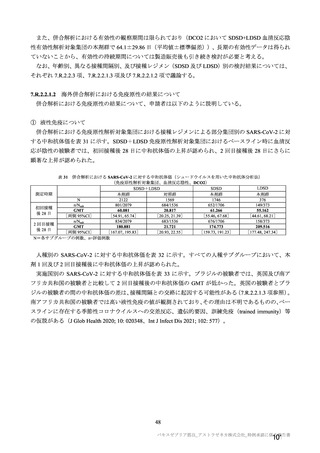
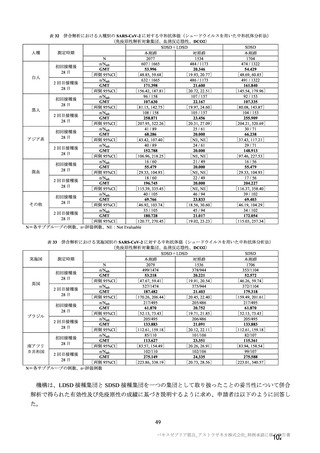
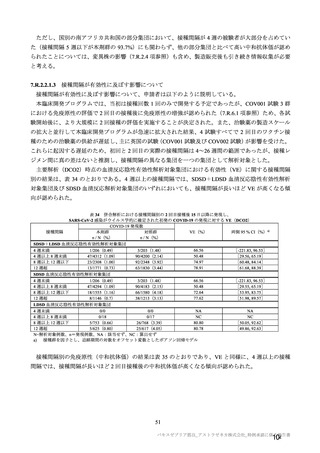
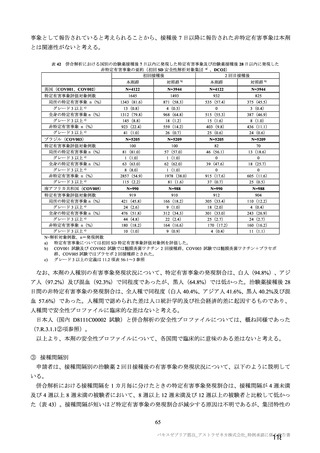
有効性について、主要な解析対象とされた SDSD+LDSD 血清反応陰性有効性解析対象集団において、
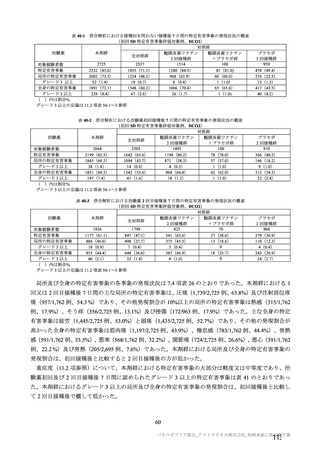
主要評価項目である COVID-19 イベント発現の中間解析(DCO1)の結果及び累積発現率は表 24 及び図
2 のとおりであり、VE の両側 95.84%CI の下限は有効性に関する基準として予め設定された 20%を上
回った。
14) 追跡期間は[リスクがある最終日-(治験薬 2 回目接種日+15 日)]+1(日)として算出された。リスクがある最終日とは、SARSCoV-2 感染がウイルス学的に確定された COVID-19 と診断された患者については最初のイベント発現日、イベントが認められずに試験
を完了又は中止した参加者については試験の完了/中止日、解析時点においてイベントが認められずに治験継続している参加者について
は解析のデータカットオフ日とされた。
31
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
84