参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2021 年 4 月 6 日))。
COVID-19 の初期症状は、インフルエンザや感冒に似ており、発症初期に判別することは困難である。
SARS-CoV-2 曝露から発症までの潜伏期間は 1~14 日間であり、通常は 5 日程度で発症することが多い
( https://www.who.int/publications/i/item/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipcprecaution-recommendations(最終確認日:2021 年 4 月 6 日))。発症前から感染性があり、発症から間
もない時期の感染性が高いこと及び無症候性の場合もあることが市中感染の原因とされており、ウイル
スの伝染を制御することを困難にしている。発熱、咳嗽、倦怠感、呼吸困難、味覚障害、嗅覚障害等の
症状が多くの患者に認められ、約 80%の患者は軽症のまま 1 週間程度で治癒するが、約 20%は肺炎症状
が増悪し、約 5%は人工呼吸器を必要とする急性呼吸窮迫症候群や多臓器不全に至り、2~3%が致命的な
経過をたどる(JAMA 2020; 323: 1239-42)。2021 年 3 月 2 日時点において本邦で「SARS-CoV-2 による
感染症」の治療に対して承認されている医薬品としてレムデシビルがあり、デキサメタゾンは既承認の
効能・効果の範囲で使用可能であるが、これらの治療を行っても、本邦の感染者、重症者及び死亡者の
報告数は増加が続いており、医療体制のひっ迫も問題となっている。そのため、感染拡大対策として、
SARS-CoV-2 ワクチンによる COVID-19 の発症予防が期待され、早期のワクチン開発が求められている。
2021 年 3 月時点で、本邦では SARS-CoV-2 による感染症の予防等を目的とするワクチンとして、コミナ
ティ筋注(ファイザー株式会社)が承認されているものの、SARS-CoV-2 感染の規模、持続的で急速な
感染拡大、世界的大流行による医療及び社会経済への影響の大きさ、並びに世界規模のワクチン接種に
伴う供給量の課題から、複数種類のワクチンの迅速な供給が求められている。
本剤は、SARS-CoV-2 の S タンパク質をコードする非増殖型遺伝子組換えチンパンジーアデノウイル
スベクターワクチンである。多くのヒトはヒトアデノウイルス血清型に対する免疫を既に獲得しており、
ヒトアデノウイルスを用いたウイルスベクターでは免疫応答が誘導されない懸念があることから、本剤
ではチンパンジーアデノウイルスが用いられた。標的抗原として選択された S 糖タンパク質サブユニッ
トは、受容体結合ドメインを介して細胞受容体 ACE2 と結合し、ウイルスと細胞の膜融合を誘導する。
本剤の発現する遺伝子組換え S 糖タンパク質の核酸配列は、ChAdOx1 ウイルスベクターへ挿入され、そ
の他の SARS-CoV-2 の成分は本剤には含まれていない。S 糖タンパク質の導入遺伝子及び遺伝子産物は
毒性又は病原性を有さず、ウイルスベクターの複製又は組換えに寄与しない。
海外では、SARS-CoV-2 による感染症の予防を目的として、英国オックスフォード大学により開発が
開始され、オックスフォード大学を治験依頼者とする海外臨床試験 5 試験(COV001、COV002、COV003、
COV004 及び COV005 試験)が継続中であるが(2021 年 3 月末時点)、現在はオックスフォード大学か
らアストラゼネカ社に開発が移管されている。国内では、2020 年 8 月よりアストラゼネカ社により国内
臨床試験(D8111C00002 試験)が開始され、2021 年 3 月末時点で試験継続中である。
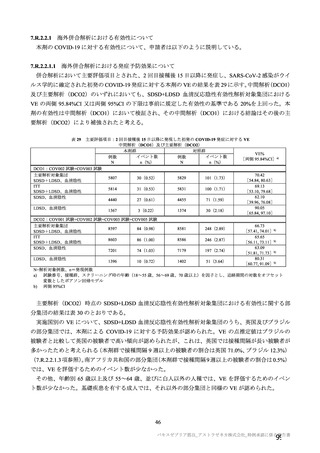
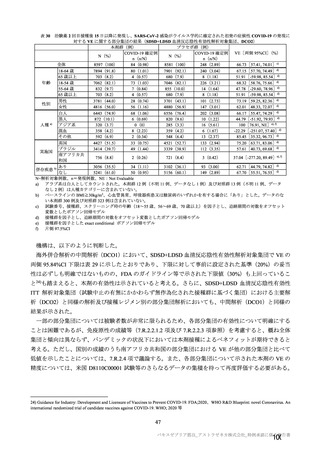
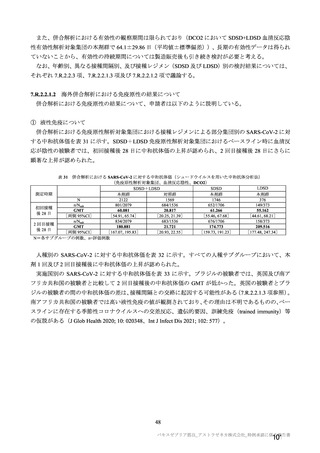
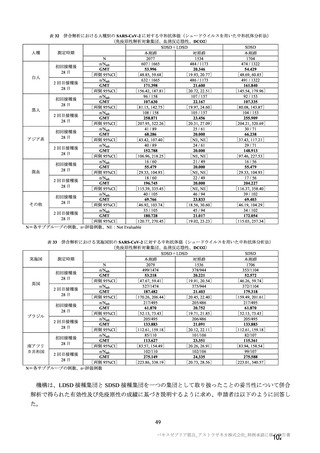
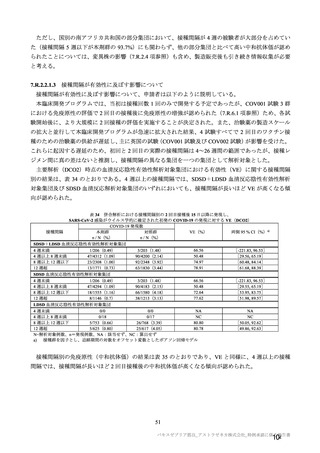
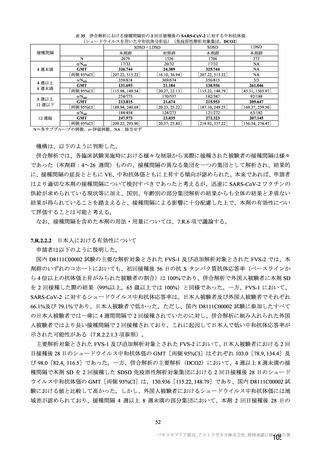
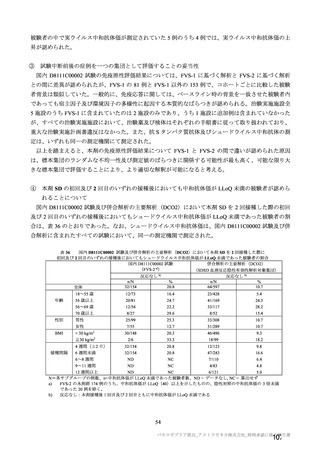
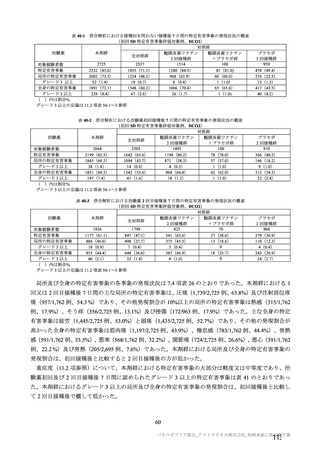
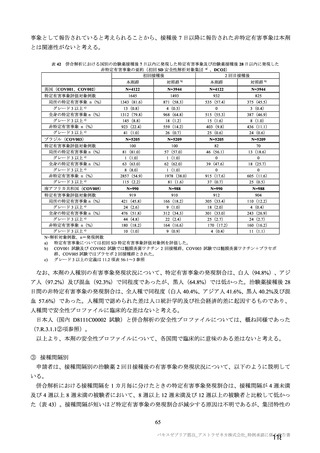
海外臨床試験 4 試験(COV001、COV002、COV003 及び COV005 試験)の併合解析における COVID19 発症予防効果及び安全性のデータに基づき、COVID-19 の予防に対して、英国では 2020 年 12 月 29 日
に暫定的使用が許可され、欧州では 2021 年 1 月 29 日に条件付き承認がなされた。
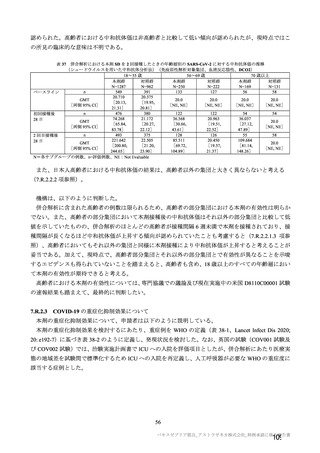
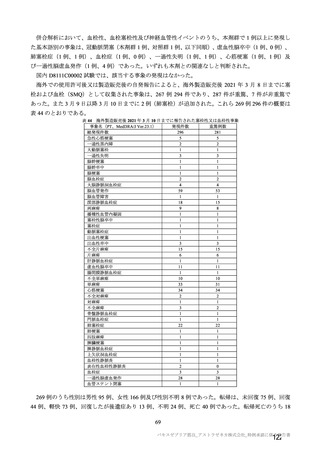
今般、欧州において条件付き承認がなされたこと、免疫原性及び安全性を評価する国内 D8111C00002
試験の成績の一部が得られたこと等から、2021 年 2 月 5 日にアストラゼネカ株式会社により、海外臨床
試験 4 試験(COV001、COV002、COV003 及び COV005 試験)の併合解析の成績を主要な根拠として、
本邦での製造販売承認申請がなされた。なお、国内 D8111C00002 試験の一部の試験結果は本承認審査中
に提出された。
3
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
56