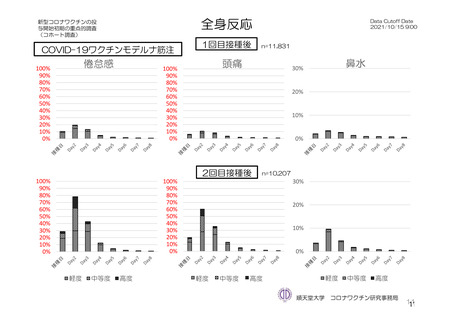
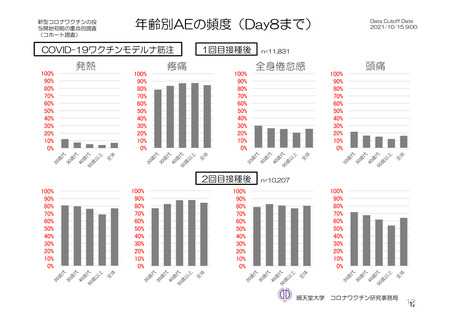
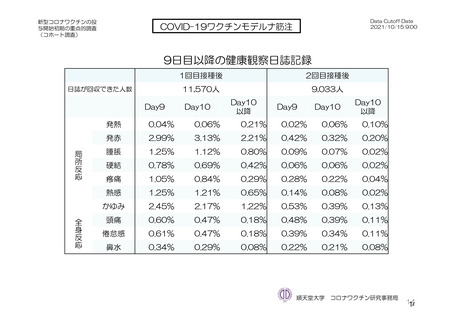
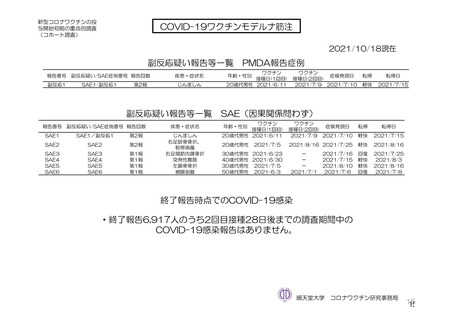
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (127 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
状出血)が認められた場合は、直ちに受診するよう被接種者に指導する旨が注意喚起されている。
同年 4 月 7 日時点で、ほとんどの EU 諸国は本剤の接種を再開しているが、一部の国では本剤接種の
年齢制限を設け、一部の国は中断の継続を公表している。
機構は、以下のように判断した。
血栓性、血栓塞栓性及び神経血管性イベントについて、本剤との因果関係は現時点では不明であるも
のの、臨床試験及び海外製造販売後において本剤接種後に血栓性、血栓塞栓性及び神経血管性イベント
が複数発現していること並びに発現した事象の重篤性を踏まえ、本剤の製造販売後の安全性検討事項と
して設定した上で、製造販売後に発現状況について調査する必要があると考える。また、海外製造販売
後に報告されているこれらの事象の中には CVST 等のまれな事象もあり、これらの多くは非高齢者で認
められていることも踏まえ、本剤接種後に血栓性、血栓塞栓性及び神経血管性イベントの発現が報告さ
れていること、これらの血栓性イベントの内容、発現が認められている年齢層、発現時期(多くは本剤
接種から 14 日以内)、初期症状等について、添付文書及び資材等において情報提供する必要がある。
以上の機構の判断については、専門協議での議論も踏まえて、最終的に判断したい。
7.R.3.3
特殊な集団における安全性について
基礎疾患を有する人、高齢者及び妊婦における安全性について、以下のとおり検討を行った。
7.R.3.3.1
基礎疾患を有する人における安全性
機構は、SARS-CoV-2 ワクチン接種の必要性が高いと考えられる COVID-19 の重症化リスクが高い基
礎疾患を有する被接種者における本剤の安全性について、申請者に説明を求め、申請者は以下のように
説明している。
併合解析に用いた 4 つの臨床試験のベースライン時において、COVID-19 の悪化、合併症の発現及び
死亡の危険因子として、事前に設定した基礎疾患及び背景を有する被験者の情報を収集した。これらの
基礎疾患には、心血管疾患(高血圧及びその他の心血管疾患を含む)、呼吸器疾患、2 型糖尿病、及び
BMI 30 kg/m2 以上が含まれる。3 分の 1 を超える被験者(本剤群 36.5%、対照群 36.7%)がベースライン
時に COVID-19 のリスク因子と考えられる基礎疾患を有していた。その主な内訳は、肥満(54.5 %)、
高血圧(25.5 %)及び喘息(18.8 %)であった。
ベースライン時に基礎疾患を有さない被験者と比較して、基礎疾患を有する被験者で、特定有害事象
及び非特定有害事象の発現割合及び重症度は類似していた。なお、基礎疾患として、悪性腫瘍、慢性閉
塞性肺疾患、慢性腎疾患又は固形臓器移植による免疫不全状態を有する被験者における本剤の安全性に
関するデータは得られていないものの、安全性が一般集団と異なることを示唆するエビデンスは得られ
ていない。
重度又はコントロール不良の基礎疾患を有する患者及び重度の免疫不全の患者における安全性情報は
不足しており、安全性が一般集団と異なる可能性は否定できないことから、RMP の重要な不足情報に設
定し、製造販売後の使用実態下において情報を収集し、追加の安全対策の要否を検討する。
機構は、申請者の説明を了承した。ただし、臨床試験に組み入れられた基礎疾患を有する被験者は比
較的安定した状態であった一方、製造販売後には様々な状態の基礎疾患を有する人への接種が想定され
74
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
127