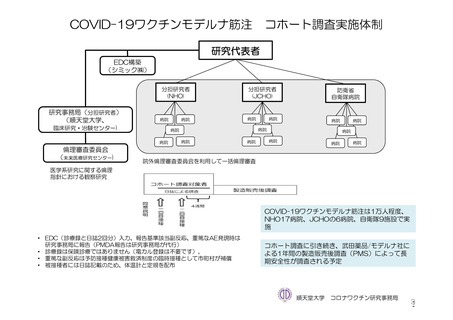
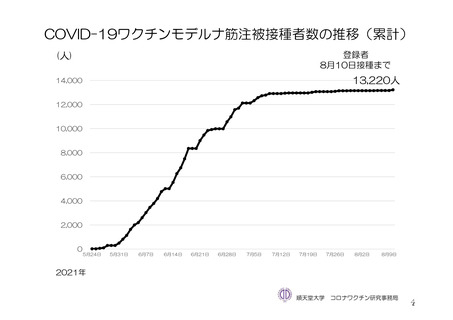
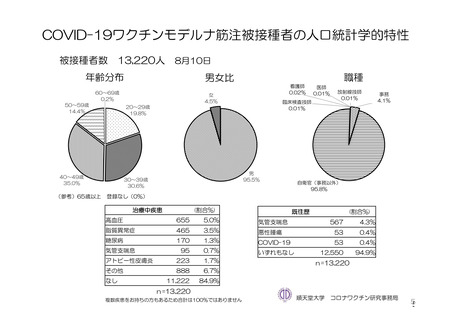
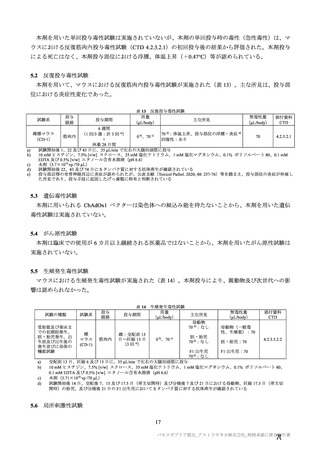
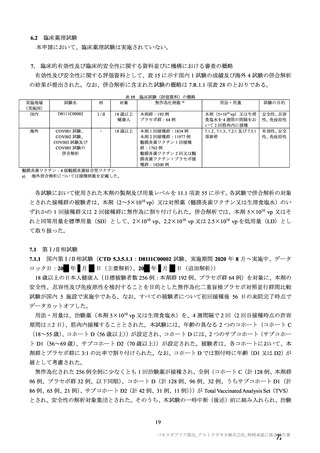
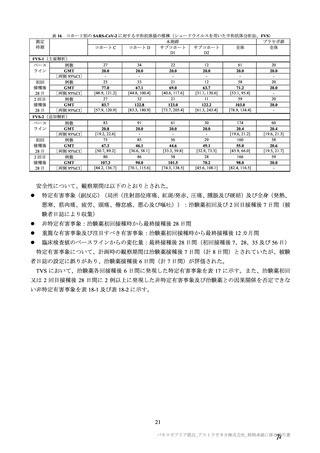
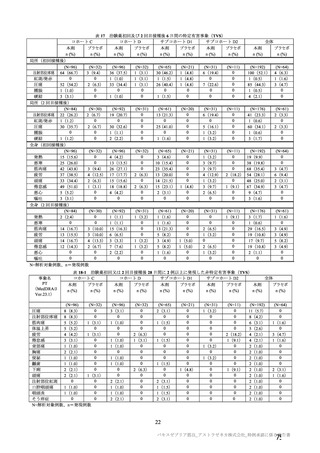
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (154 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和 3 年 5 月 13 日
申請品目
[販
売
名]
バキスゼブリア筋注
[一
般
名]
コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベ
クター)
[申
請
者]
[申請年月日]
アストラゼネカ株式会社
令和 3 年 2 月 5 日
[略語等一覧]
別記のとおり。
審査内容
1.
専門協議及びその後の機構における審査の概略は、以下のとおりである。なお、本専門協議の専門委
員は、本品目についての専門委員からの申し出等に基づき、「医薬品医療機器総合機構における専門協
議等の実施に関する達」(平成 20 年 12 月 25 日付け
20 達第 8 号)の規定により、指名した。
臨床データパッケージ及び審査方針について
1.1
報告(1)の「7.R.1 臨床データパッケージ及び審査方針について」の機構の判断は、専門委員より支
持された。
有効性について
1.2
専門協議では、専門委員より、報告(1)の「7.R.2 有効性について」の機構の判断を支持する意見に
加えて、以下の意見が出された。
有効性にかかる審査方針について、接種間隔の影響があるとの前提で、最適な接種間隔が評価可能
かではなく、影響を考慮した上で本剤の有効性が評価可能かを判断した機構の考えを支持する。
B.1.351 変異株に対する本剤の VE が極めて低い可能性があることは、医療従事者へ適切に情報提供
する必要がある。
機構は、以上の専門委員の意見について申請者に伝達し、申請者は適切に対応する旨を回答した。
1.3
1.3.1
安全性について
報告(1)以降の欧州等における動向と機構の判断について
報告(1)の「7.R.3.2.3 血栓性、血栓塞栓性及び神経血管性イベント」について、報告(1)作成以降
の欧州等における動向及び機構の判断(2021 年 4 月 9 日時点)は下記のとおりであり、専門協議におい
ては、当該機構意見について 1.3.2 ②項のとおり専門委員から意見が出された。
101
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
154