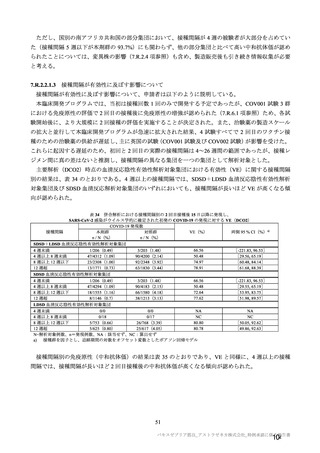
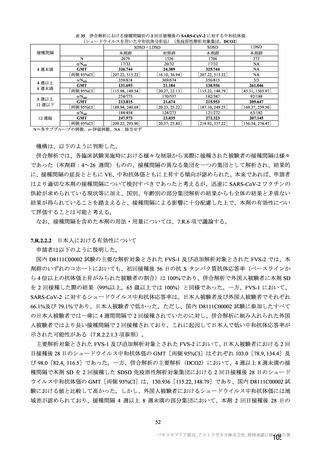
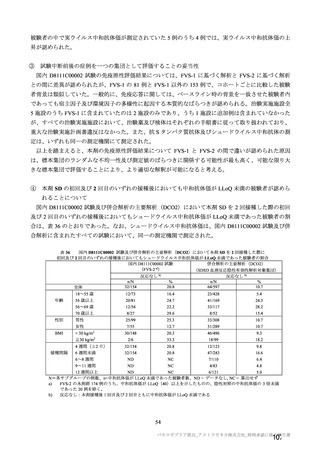
参考資料1-7 浜口班の議論における参考資料(令和3年10月25日開催)(令和3年度第6回安全技術調査会参考資料1-2) (60 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27504.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和4年度第2回 8/23)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
不純物F*
及び
不純物E*
は、いずれも製造工程で恒常的に除去されることが確認されている。
原薬の管理
2.1.7
原薬の規格及び試験方法として、性状、確認試験(qPCR)、浸透圧、pH 試験、DNA:タンパク質比、
ウイルス粒子:感染性ウイルス粒子比、
不純物C*
、宿主細胞由来
(qPCR)、宿主細胞由来 不純物B*
不純物A*
(ELISA)、エンドトキシン、微生物限度、生物学的活性(感染価)、ポリソルベート 80 及び定
量法(ウイルス粒子濃度)が設定されている。
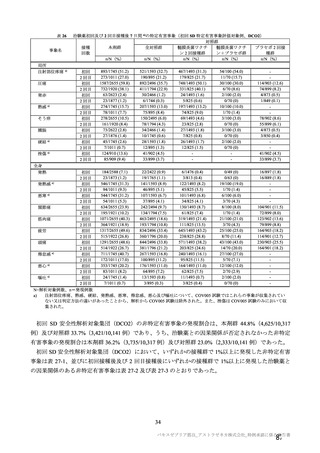
原薬の安定性
2.1.8
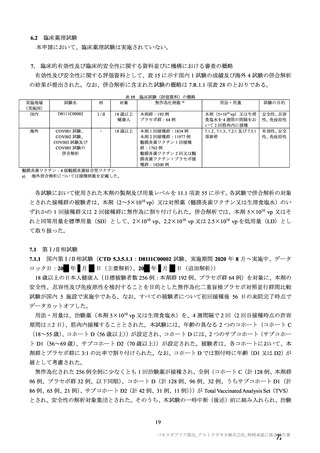
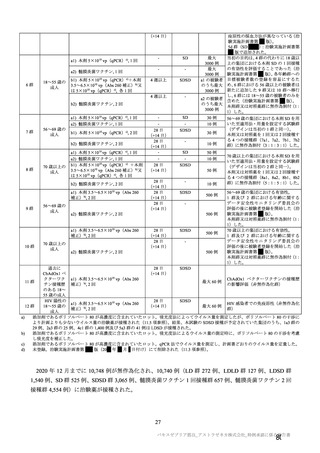
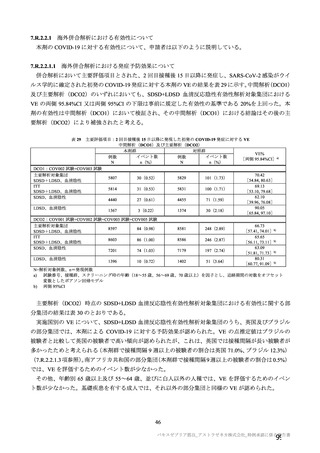
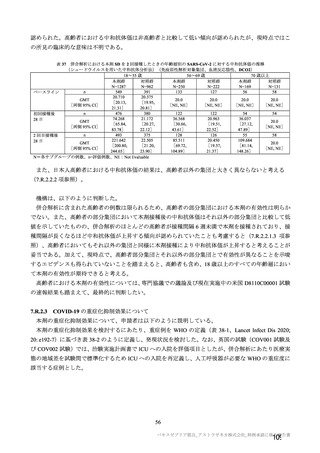
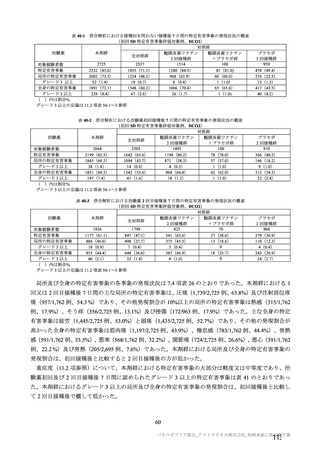
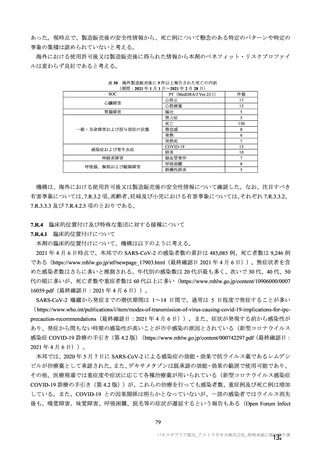
原薬の安定性試験は、表 4 のとおりである。
保存条件
-90℃~
-55℃
長期保存試験 1)
5±3℃
加速試験
25±2℃/60
±5%RH
表 4 原薬の安定性試験(2021 年 3 月時点)
製法
ロット数
試験期間
2
4 カ月
製法 c2)
1
3 カ月
3
2 カ月
3)
製法 d
3
1 カ月
1
6 カ月
製法 c
2
4 カ月
4
2 カ月
製法 d
2
1.5 カ月
製法 c
3
2 カ月
製法 d
3
2 カ月
保存形態
製容器
製容器
製容器
製容器
製容器
製容器
1) 長期保存試験(-90℃~-55℃及び 5±3℃)は 12 カ月まで継続中
2)
社原薬、3)
社原薬
長期保存試験では、実施期間を通して、製法 c 及び製法 d の原薬における品質特性に明確な変化は認
められず、規格に適合した(有効期間については 2.R.1 項参照)。
2.2
製剤
2.2.1
製剤及び処方並びに製剤設計
本剤は、1 バイアルあたり 1×1011 vp/mL の濃度の本薬を含有する 10 回接種用のバイアル製剤である。
表示容量 5 mL に対し、10 回の採取が可能となるよう過量充填されている。製剤には、L-ヒスチジン/Lヒスチジン塩酸塩水和物、塩化ナトリウム、塩化マグネシウム、エデト酸ナトリウム水和物、精製白糖、
ポリソルベート 80、エタノール及び注射用水が添加剤として含まれる。一次容器はガラス製バイアル(容
量 10 mL)及びブロモブチルゴム栓、二次包装は紙箱である。
2.2.2
製造方法
製剤の製造工程は、原薬の受入及び保管、融解、
及び混合、バイオバーデン低減ろ過、混合、無
菌ろ過、無菌充填、打栓及び巻締め、外観検査、表示、包装並びに保管の各工程からなる。製剤は、ガ
ラス製バイアルにて 2~8℃で保存される。重要工程は、
及び
及び混合、
、
、並びに
とされている。
製剤の製造工程について、実生産スケールにおけるプロセスバリデーションが実施されている。
7
*新薬承認情報提供時に置き換え
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
60