資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (128 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和 3 年 5 月 13 日
独立行政法人医薬品医療機器総合機構
承認申請のあった下記の医薬品にかかる医薬品医療機器総合機構での審査結果は、以下のとおりであ
る。
記
[販
売
名]
バキスゼブリア筋注
[一
般
名]
コロナウイルス(SARS-CoV-2)ワクチン(遺伝子組換えサルアデノウイルスベク
ター)
[申
請
者]
アストラゼネカ株式会社
[申請年月日]
令和 3 年 2 月 5 日
[剤形・含量]
1 バイアル中に有効成分としてコロナウイルス(SARS-CoV-2)ワクチン(遺伝子組
換えサルアデノウイルスベクター)5×1011 ウイルス粒子量を含有する注射剤
[申 請 区 分 ] 医療用医薬品(1)新有効成分含有医薬品
[特 記 事 項 ] 本品目は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づく第 14 条第 1 項の承
認に該当する品目として取り扱われた。
[審査担当部]
ワクチン等審査部
[審 査 結 果 ]
別紙のとおり、提出された資料から、本品目の、SARS-CoV-2 による感染症の予防に対する有効性は
示され、認められたベネフィットを踏まえると安全性は許容可能と判断する。
以上、医薬品医療機器総合機構における審査の結果、本品目については、下記の承認条件を付した上
で、以下の効能又は効果並びに用法及び用量で承認して差し支えないと判断した。
[効能又は効果]
SARS-CoV-2 による感染症の予防
[用法及び用量]
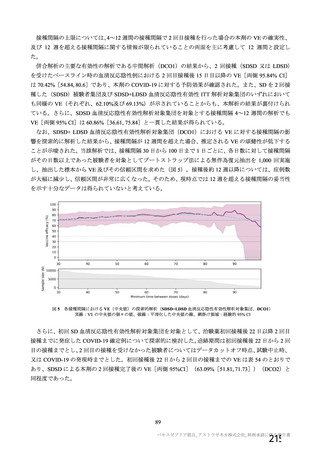
1 回 0.5 mL を 4~12 週間の間隔をおいて 2 回筋肉内に接種する。
[承 認 条 件 等 ]
1.
本剤は、承認に当たり、医薬品医療機器等法第 14 条の 3 第 2 項の規定に基づき、医薬品医療機器
等法施行令第 28 条第 3 項各号に掲げる以下の義務を課すこととしたこと。
(1) 第 1 号関係
本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された特例承認品目で
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
125