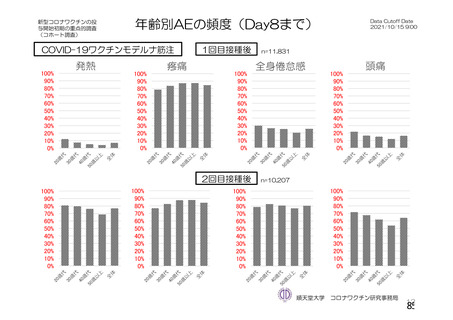
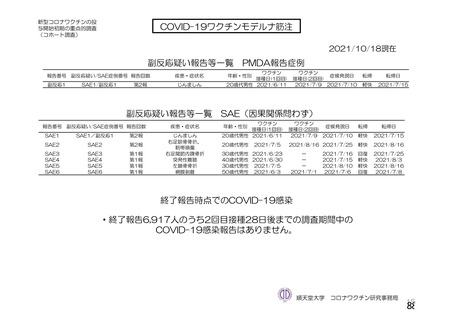
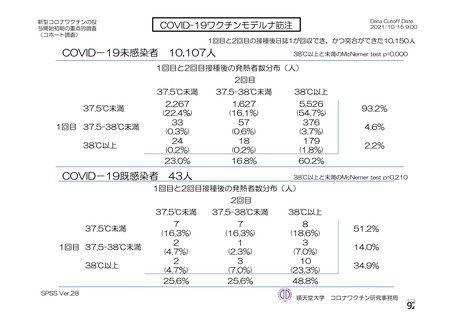
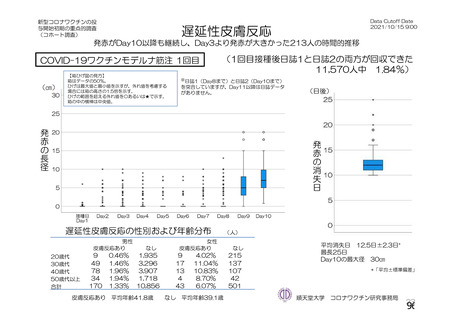
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (214 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
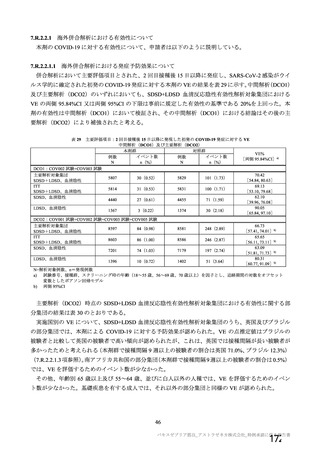
ベクター中和抗体価の中央値[範囲]は、初回接種後 28 日目で 506[321, 1246]、2 回目接種後 28 日目
で 432[181, 622]であり、2 回目接種後に抗 ChAdOx1 ベクター中和抗体価の増加は認められなかった。
また、2 回目接種後 28 日目の抗 ChAdOx1 ベクター中和抗体価と抗 S タンパク質抗体価又は S タンパク
質特異的 T 細胞応答の相関性を解析した結果、2 回目接種後の SARS-CoV-2 抗原に対する免疫応答は抗
ChAdOx1 ベクター免疫による影響をほとんど受けないことが示唆された。なお、今後、併合解析の免疫
原性解析対象集団においても抗 ChAdOx1 ベクター中和抗体の分析が行われる計画である。
② 過去に本剤以外のアデノウイルスベクター製剤(ワクチン、遺伝子治療用製品等)を使用した者に
本剤を接種した場合の有効性及び安全性について
申請者は、以下のように説明した。
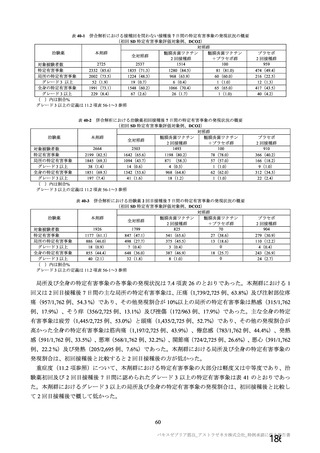
本剤の臨床データパッケージに含まれた試験のうち COV002 試験以外の臨床試験では、過去にアデノ
ウイルスベクターワクチンの接種を受けたことがある被験者を除外し、併合解析においても過去に
ChAdOx1 ベクターワクチンを接種したことのある群の被験者(COV002 試験の 11 群)は除外した。し
たがって、併合解析の成績からは、過去に他の ChAdOx1 ベクターワクチン又は他のアデノウイルスベ
クター製剤を接種したことがある被験者に本剤を接種した場合の有効性及び安全性は不明である。
一方、COV002 試験では、過去に本剤以外の ChAdOx1 ベクターワクチンを接種したことがある被験者
に特化したコホート(11 群)を設定することにより、SARS-CoV-2 抗原に対する免疫応答への抗 ChAdOx1
ベクター免疫が及ぼす影響を評価している。11 群の被験者及び過去に ChAdOx1 ベクターワクチンの接
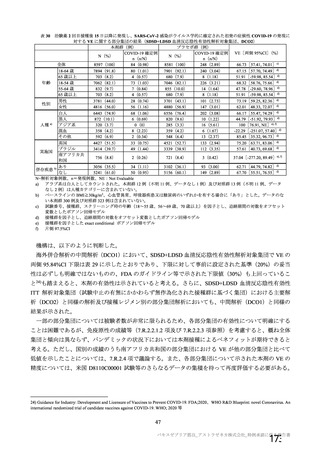
種歴のない 18~55 歳の被験者における本剤初回接種後 28 日目の抗 S タンパク質抗体価(GMT[95%
CI])は、それぞれ 132.1[54.55, 319.9]及び 214.10[156.26, 293.36]であり、11 群の被験者の抗 S タ
ンパク質抗体価がわずかに低かった。しかしながら 4 週間の接種間隔で本剤 2 回目接種後 28 日目の抗 S
タンパク質抗体価(GMT[95% CI])は、それぞれ 679.5[399.4, 1156]及び 627.88[475.82, 828.53]で
あり、被験者の間で類似していた。
以上のことから、本剤を 2 回接種する場合、既存の抗 ChAdOx1 ベクター免疫による影響はほとんど
受けないことが示唆された。したがって、過去に本剤以外の ChAdOx1 ベクターワクチンを接種したこ
とのある者への本剤接種は可能と考える。
機構は、以下のように判断した。
申請者の説明に加え、免疫原性解析対象集団において SARS-CoV-2 に対する中和抗体価が 2 回目接種
後に増加してブースター効果が認められていることも踏まえると(7.R.2.2.1.2 参照)、2 回目接種後の S
タンパク質に対する免疫応答への抗 ChAdOx1 ベクター免疫が及ぼす影響は限定的であると考える。た
だし、抗 ChAdOx1 ベクター免疫が本剤の有効性、免疫原性及び安全性に及ぼす影響に関する情報は限
られること、また、過去に本剤以外のアデノウイルスベクター製剤を使用した者に対する本剤の接種経
験はほとんどないことを踏まえると、製造販売後にも引き続き情報収集し、新たな知見が得られた場合
には、追加の注意喚起の要否を検討する等、適切に対応する必要がある。
7.R.5
効能・効果について
申請時の効能・効果は、「SARS-CoV-2 による感染症の予防」とされていた。
85
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
211