資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (168 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
画書に規定のない挫傷を収
集
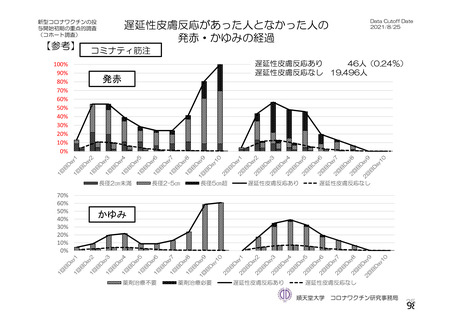
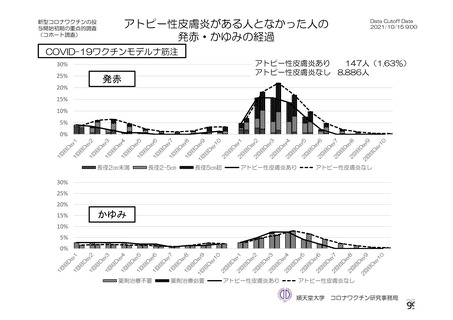
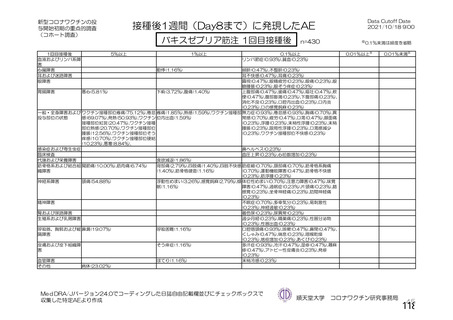
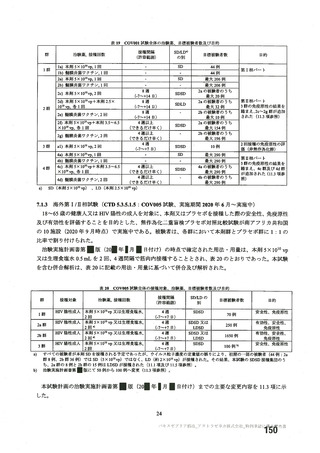
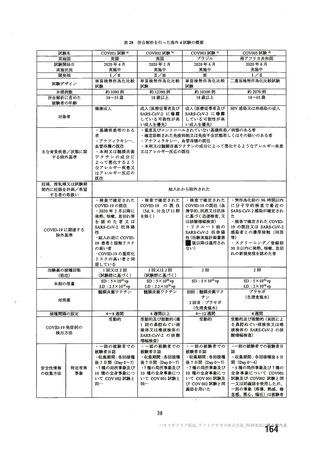
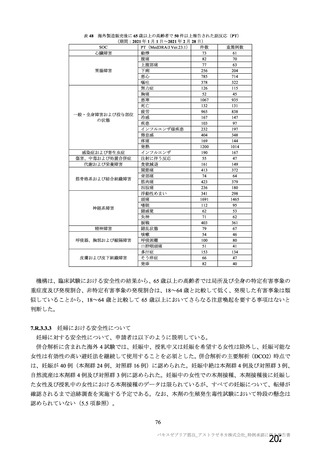
非特定有 ・収集期間 : 各回接種 | ・収集期間 : 各回接種 | ・収集期間 : 各回接種 [ ・収集期間:各回接種後 28 日
害事象 後 28 日まで 後 28 日まで 後 28 日まで まで
重症度 FDA のガイゲダンス Toxicity grading scale for healthy adult and adolescent | NIH のガイダンス DAIDS
分類 volunteers enrolled in preventive vaccine clinicai trials (FDA、2007) gTading the severity ofadult and
paediatric adverse events
予定追跡期間 最終接種後 364日 | 最終接種後364日 | 最終接種後 364晶 初回接種後 364 日
年菩月目日) 時点
年較月目日) 時点
月罰日) 時点
月較日) 時点
a) 治駿実施計画書第較講版 2
b) 治験実施計画書第較講版 (2
c) 治験実施計画書第較版 (20納年
① 治験実施計画書第較皮 (20較年
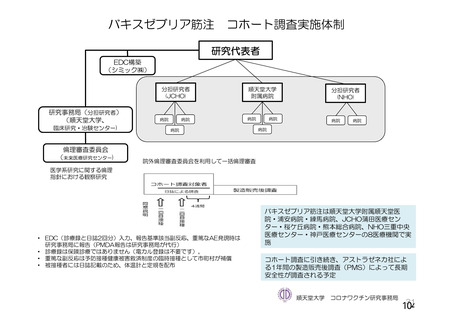
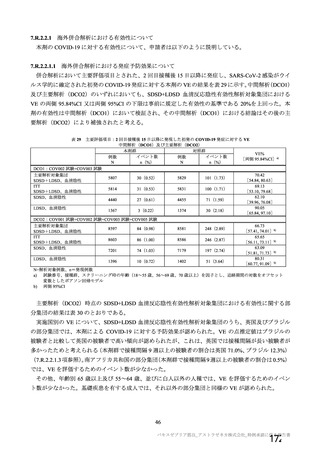
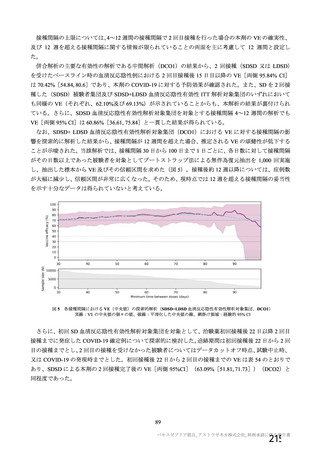
併合解析の計画時点で COV001 試験、COV002 試験、COV003 試験及び COV005 試験の 4 試験以外に
米国 D8110C00001 試験等も実施中であったが、併合解析に含める試験と して当該 4試験を選択 した理由
は、これらの試験が深刻な SARS-CoV-2 流行が始まってすぐに開始され、試験の進捗が先行していたた
めである。また、いずれの了臨床試験もオックスフォード大学が治験依頼者と して実施している試験であ
り、表28 のとおり、試験デザがイン、データ収集法、SARS-CoV-2 感染症確認法及び中央判定アロセスは
試験間で類似していることから、これらの試験を併合することは妥当と考えた。
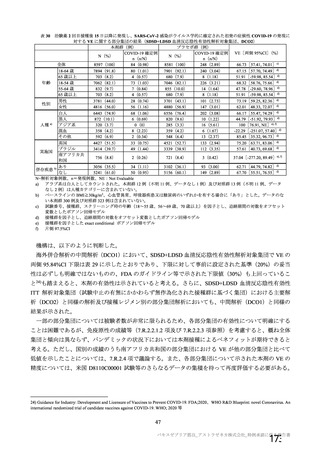
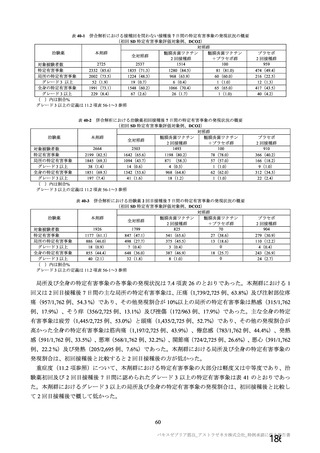
4 試験の試験デザインは、いずれも原則として無作為化比較試験で、何らかの盲検を確保する方法を
採用しており (COV001 試験、COV002 試験及び COV003 試験は単盲検、COV003 試験は二重盲検) 、
同様の対象集団において、同様の評価項目 (安全性、 免疫原性及び有効性) を用いている。 4試験の試験
デザインには不均一な部分もあり、いくつかの差異についての解析上の取扱いは、例えば下記のとおり、
あらかじめ併合解析の統計解析計画書において規定された。
@ 無作為化を行っていない和群 (例 : COV001 試験の 3 群、COV002 試験の 11 群) 、 過去に ChAdOx1
べベクターワクチンを接種した被験者 (例 : COV002 試験の 11 群) 、試験開始時に HIV 陽性と診
断された被験者 (COV002 試験の 12 群及び COV005 試験の 3 群) 及び小児 (18 歳未満) は、す
べての解析対象集団から除外する。また、本剤群が同時対照群と 1:1 で無作為化されていない千
(例 : COV002 試験の 1、2、$、7 及び8 群) は、有効性の解析対象集団から除外する。
@ 主要目的として、18 歳以上の成人における COVID-19 の予防について、2 回目の接種量を SD と
した時の本剤の 2 回の筋肉内接種時の有効性を対照と比較して推定する (7.R.2.1.2 項参照) 。
@ 有効性の主要解析は、 SDSD+LDSD 血清反応陰性有効性解析対象集団に基づくこととし、sx10"
vp 又は同等なウイルス粒子量を SD、2X10" vp、 2.2X10"" vp 又は 2.5x10"" vp を LD とする
(7.R.2.1.1 項参照) 。
@ 解析はすべて実際に受けた治験薬の用法・用量別に実施する。
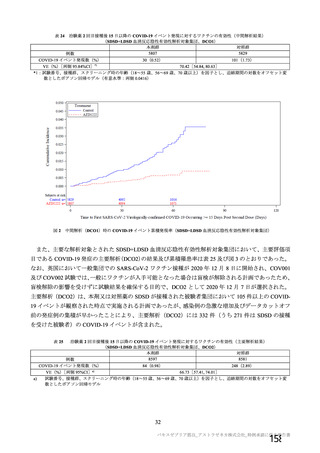
@ 有効性の主要評価項目は、治験薬 2 回目接種後 15 日以降に発現した SARS-CoV-2 感染がウイル
ス学的に確定された初発の症候性 COVD-19 とする。 核酸増幅検査が陽性となった検体の採取日
と COVTD-19 症状の発現日が 2 回目接種から 13 日以上経過している症例のみをイベントとして
含める。イベント発現日は核酸増幅検査日又は症状発現日のいずれか早い方の日とし、エンドポ
イント判定委員会が分析のために定義むる。 複数のイベントが認められた被験者については、最
初の発現のみを有効性の主要評価項目の解析に用いる (7.R.2.1.2 項参照) 。
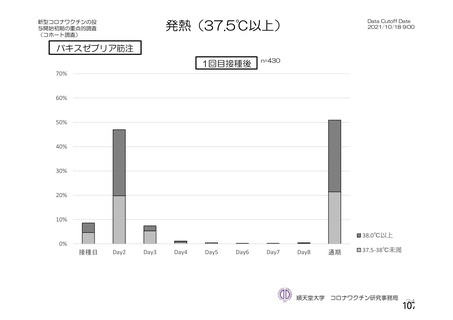
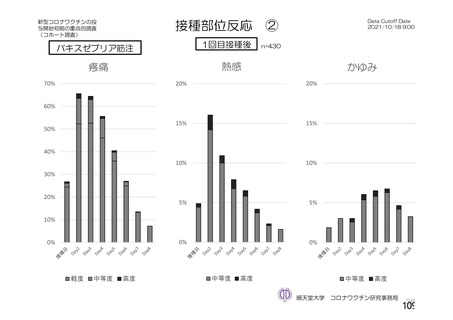
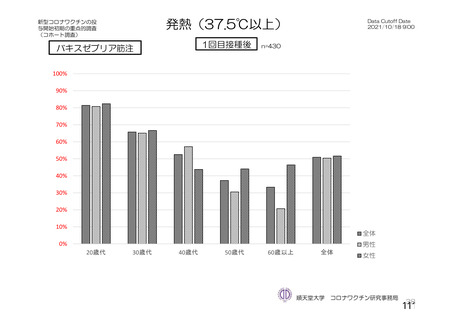
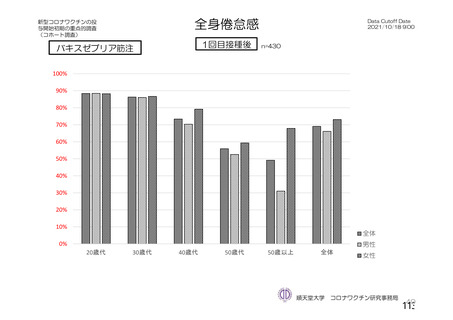
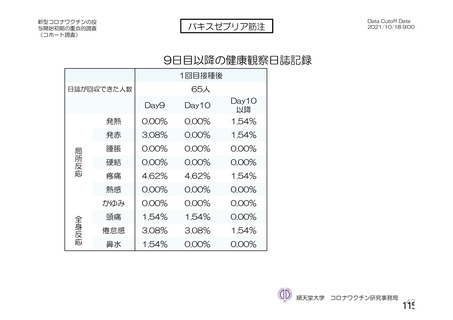
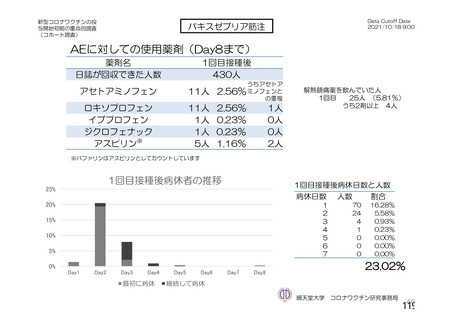
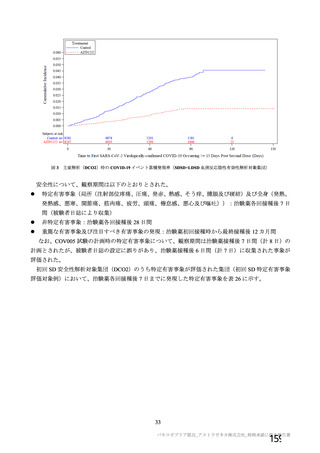
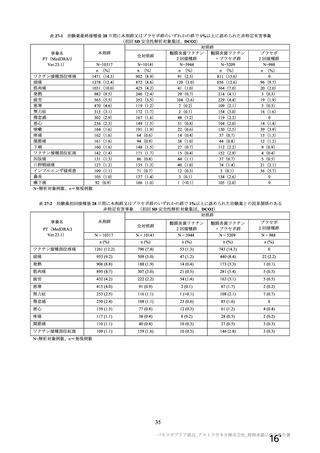
@ 特定有害事象について、 治験薬接種後 7 日間 (治験薬接種昌とそれ以降の 7 日間。 ただし COV003
試験では治験薬接種日とそれ以降の 6 日間"『 ) 収集 した局所性有害事象及び全身性有害事象をそ
18) 治験実施計画書の解釈に誤りがあったため。
39
165