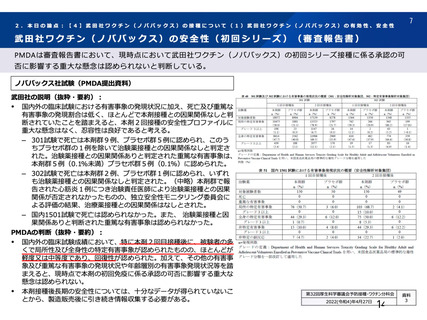
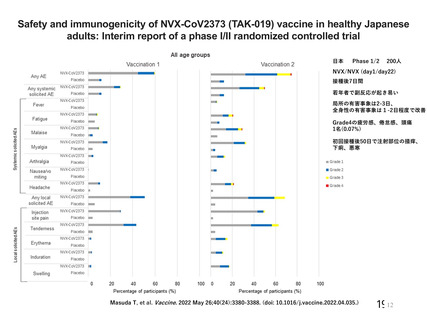
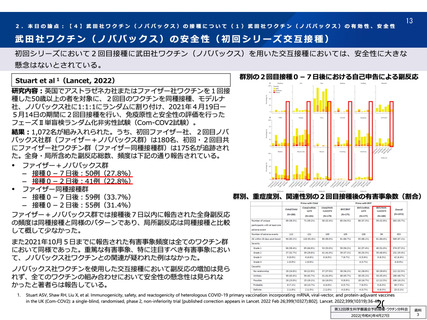
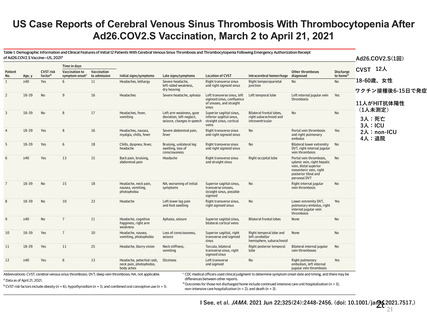
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
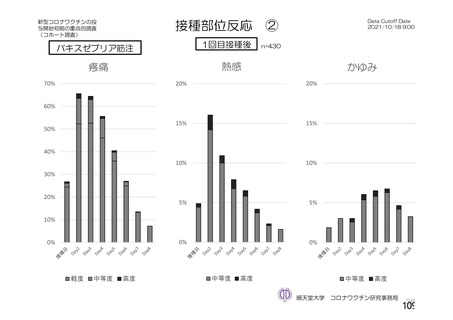
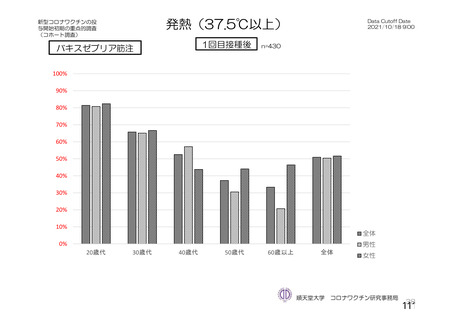
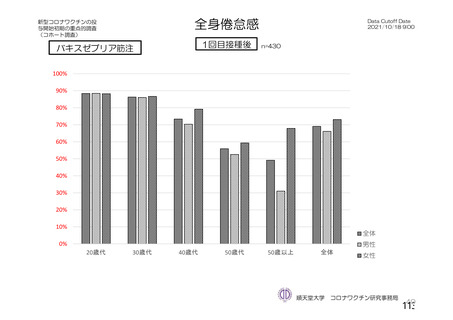
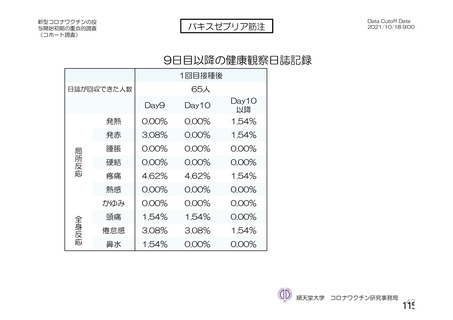
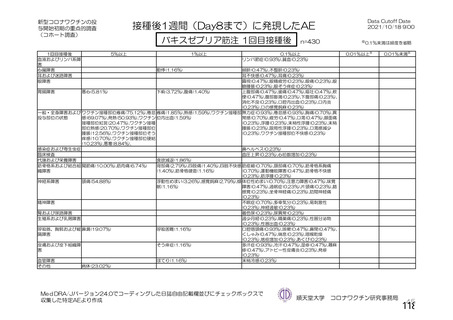
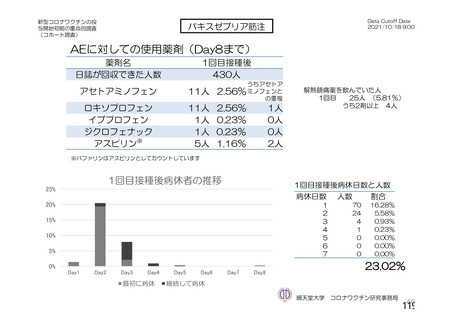
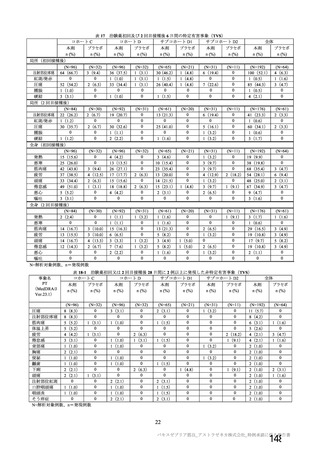
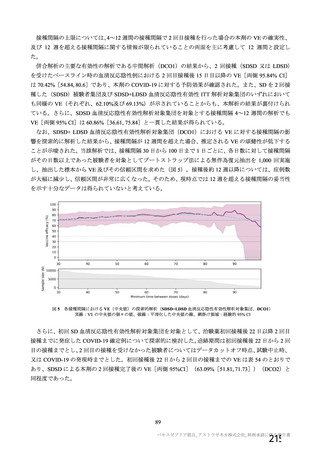
ü 新型コロナウイルスワクチンの接種が始まってから今まで、製品ごとに製造販売後の
安全性情報を踏まえてワクチン接種後の採血制限について議論を行ってきた。
ü しかし、本邦では既に多くの者がワクチン接種済みであることから、今後新しく承認
されるワクチンについては、製造販売後の安全性情報の入手が困難になることが予測
される。
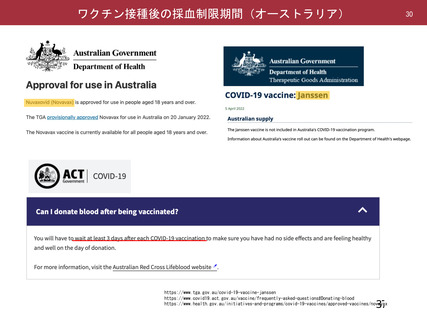
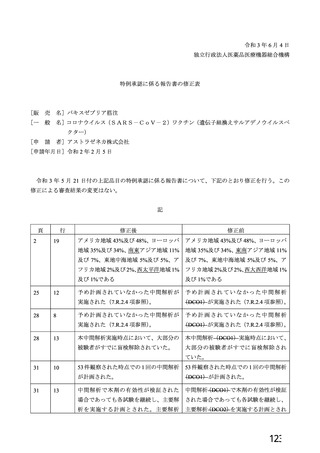
ü また、既にウイルスベクターワクチンとして2剤目となるJ&J社製のワクチンが承認
されている。
製品毎に議論していくことを今後も続けていくのかどうかについて議論が必要である。
Ø
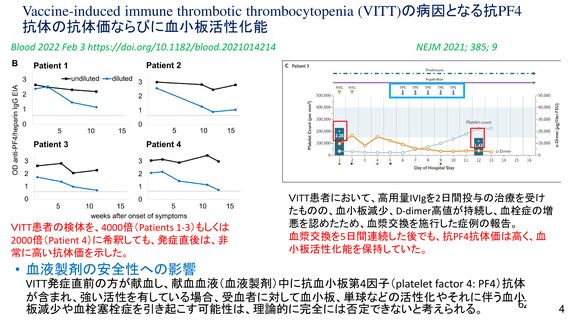
遺伝子組み換えワクチンについては、標的となるタンパク質を遺伝子組み替え技術により精製したもの
であることから、本質的に不活化ワクチンと同様と考えられるか?
Ø
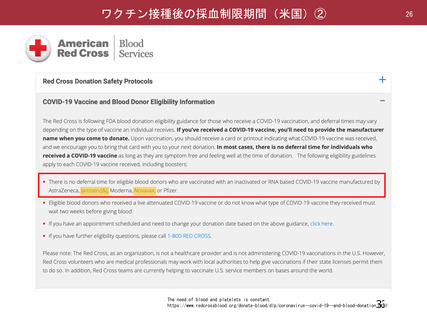
現在、ウイルスベクターワクチン接種後の採血については、アストラゼネカ社製のもののみを受け入れ
ている。同じウイルスベクターワクチンであるJ&J社製のワクチンについても、アストラゼネカ社製と
同様に考えることが可能か?
Ø
治験中のワクチンや本邦未承認のワクチンについても、既に議論済みのワクチンと同じ種類のワクチン
については、議論済みのワクチンと同じように採血制限を考えることが可能か?
Ø
議論の結果により、今後も承認されたワクチンについて個別に議論していくことはありうる。
11
4