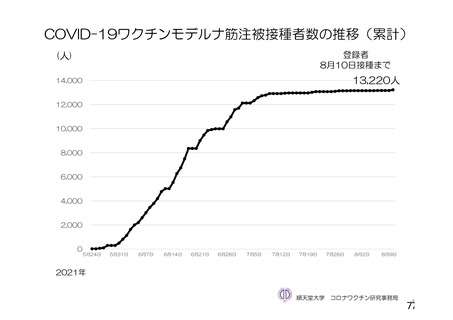
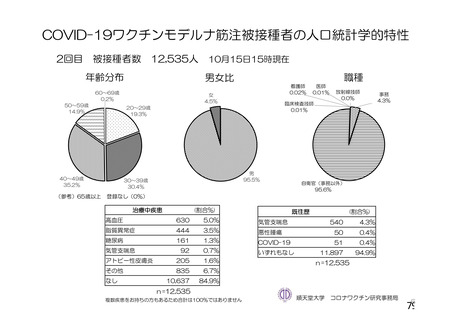
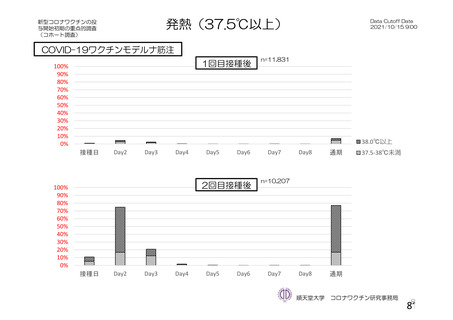
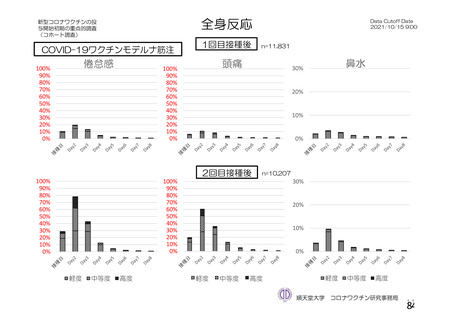
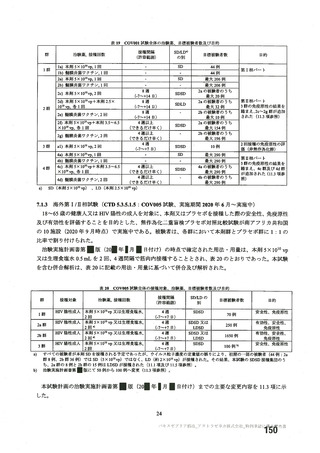
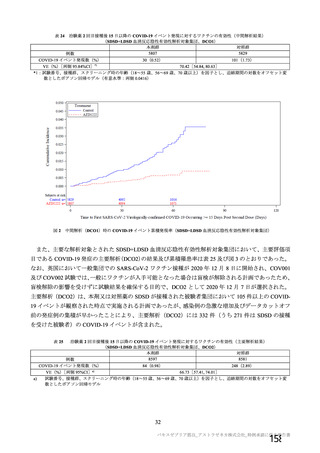
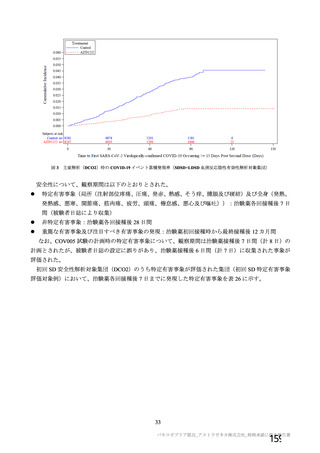
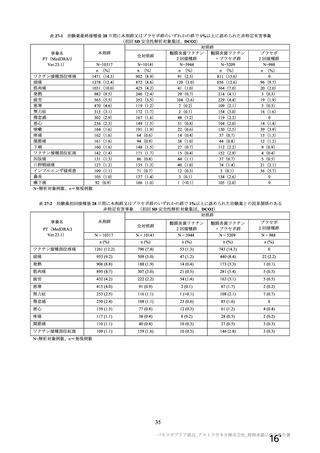
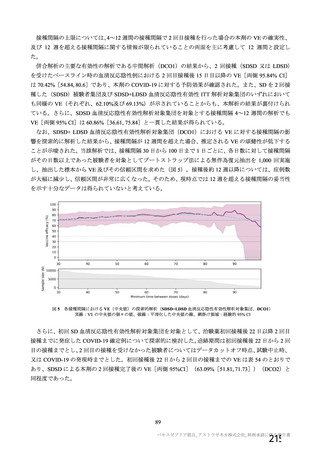
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
adults: Interim report of a phase I/II randomized controlled trial
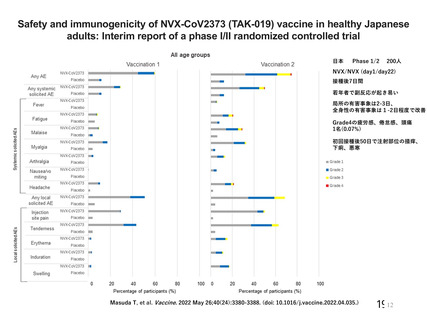
⽇本
Phase 1/2
200⼈
NVX/NVX (day1/day22)
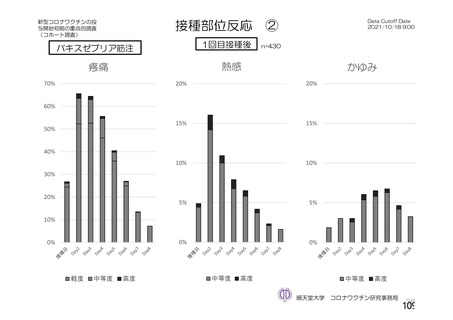
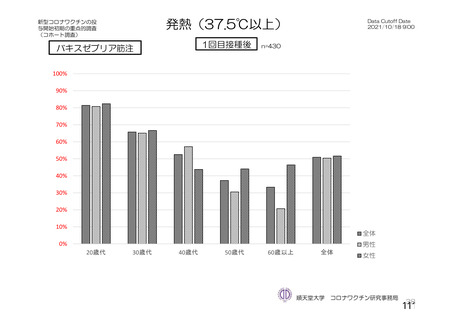
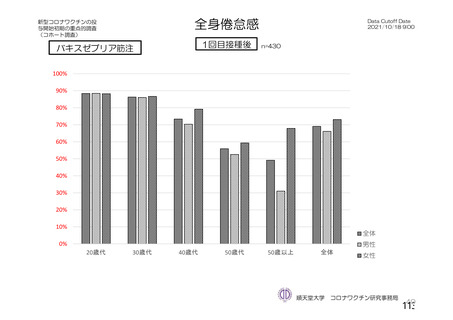
接種後7⽇間
若年者で副反応が起き易い
局所の有害事象は2-3⽇、
全⾝性の有害事象は1-2⽇程度で改善
Grade4の疲労感、倦怠感、頭痛
1名(0.07%)
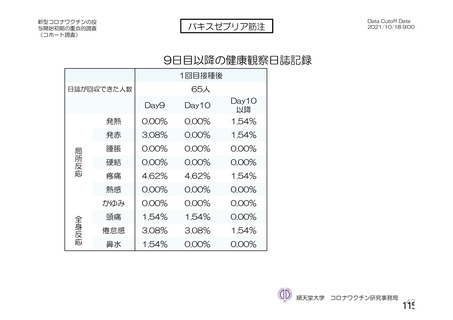
初回接種後50⽇で注射部位の掻痒、
下痢、悪寒
Masuda T, et al. Vaccine. 2022 May 26;40(24):3380-3388. (doi: 10.1016/j.vaccine.2022.04.035.)
19 12