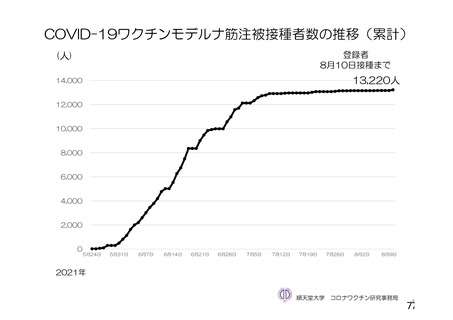
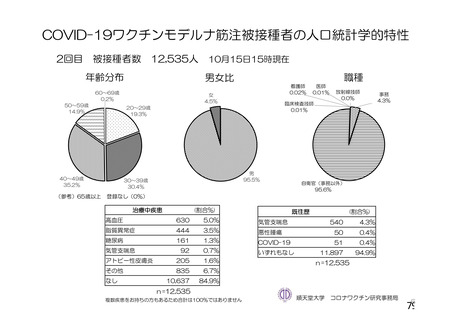
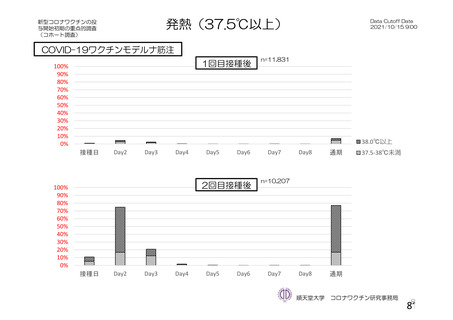
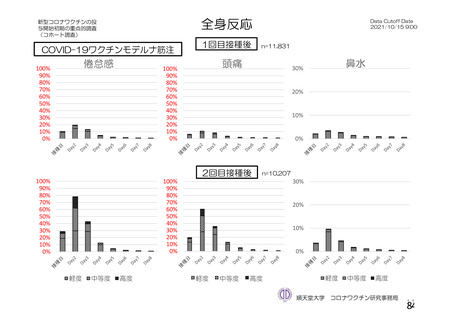
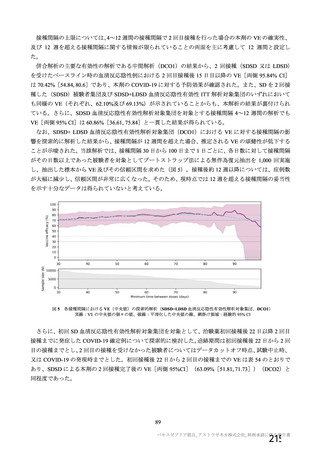
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (213 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
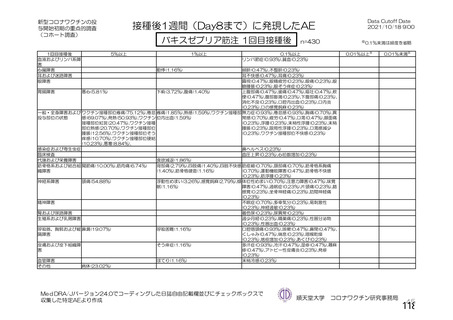
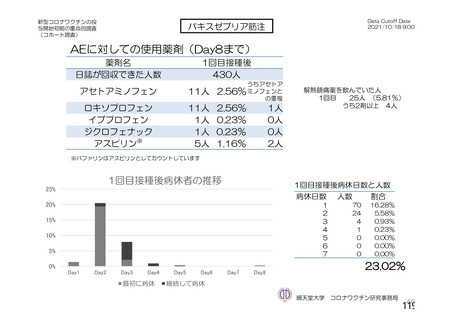
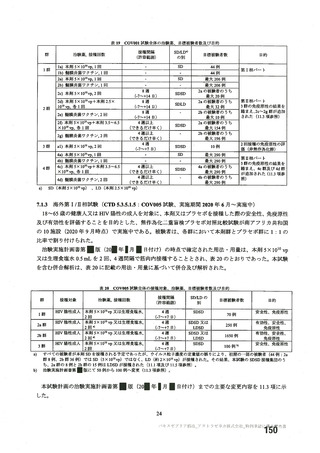
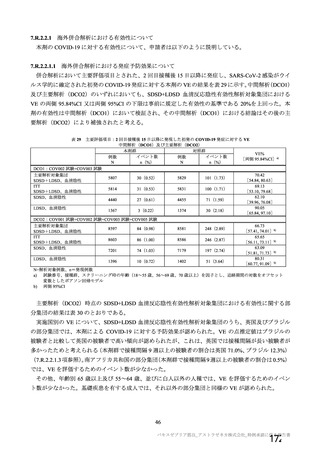
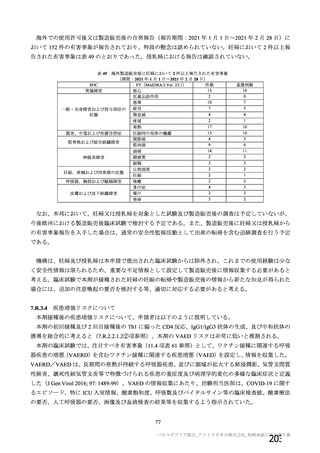
(期間 : 2021 年 1 月 1 日一2021 年 2 月 28 日)
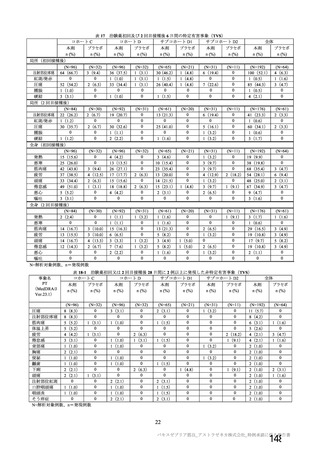
SOC PT (MedDRA7 Ver.23.1) 件数 重篤例数
胃腸障害 上腹部痛 $ $
下痢 16 8
悪心 27 16
路吐 9 $
一般・全身障害および投与部位 | 医薬品副作用 6 3
の状態 加寒 48 32
疲労 29 13
疾患 6 4
インフルエンザ様疾患 10 6
修怠感 9 3
商痛 12 6
発熱 59 24
感染症および寄生虫症 インフルエンザ $ 2
筋朋格素および結合組織障害 関節痛 13 7
筋肉痛 1611
四肢痛 10 3
神経系障害 浮動性めまい 13 8
頭痛 67 35
錯感覚 7 3
振潤 10 3
呼吸器、胸部および縦隔障害 咳貴 6 1
呼吸困難 8 3
皮膚および皮下組織障害 多汗症 10 4
血管障害 末本冷感 5 3
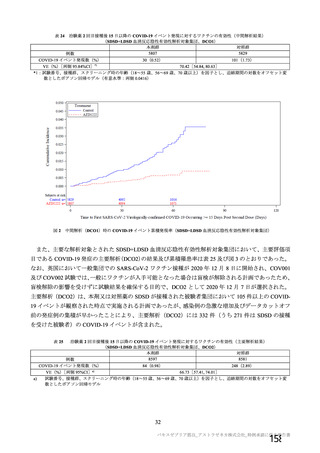
現在グローバルでは、 0て18 歳の小児を対象に 20軒年目月に試験への組入れを開始することを目標と
して開発を進めており、本邦においても成人での用法・用量が確定次第本剤の小児開発について検討を
開始する予定でもる。なお、オックスフォード大学は、618 歳の小児を対象に本剤を接種した際の安
全性と免疫応答を評価する了臨床試験を開始している。
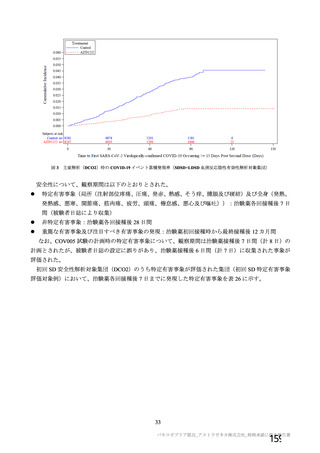
機構は、以下のように判断した。
本邦における SARS-CoV-2 の小児での感染状況について、日本小児科学会及び日本川崎病学会による
と、COVID-19 は比較的軽症で、多くの場合は治療を必要としないものであり、2021 年 2 月 23 日時点
で、国内において 10 歳未満の小児は約 1 万人、10 歳代の小児は約 2 万人が COVID-19 に槍患している
が死亡例の報告はないこと、及び少数ながら重症化した小児も認められるもののいずれも治療によって
回復したことが報告されている (「新型コロナウイルス感染症の小児重症例について」 日本小児科学会、
日本川崎病学会、http:/www.jpeds.or.jp/modules/guidelines/index.php?content id=129 (最終確認日 : 2021 年
4月6日) ) 。18歳未満の小児に本剤を接種したときの有効性及び安全性に関する臨床試験成績は得ら
れておらず、現時点では積極的に本剤の接種を推奨すべき対象ではないと考える。一方で、上記のとお
り少数ながら重症化する小児も認められることから、小児を対象とした臨床試験を実施し、小児に対す
る本剤の有効性及び安全性について検討することは重要であると考える。
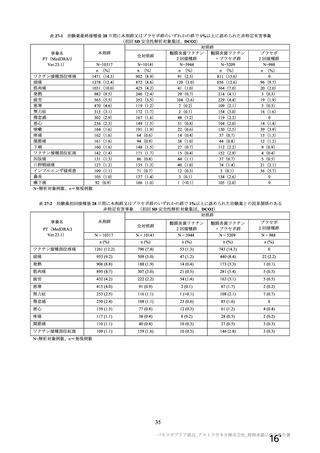
7.R.4.2.6 過去に本剤を含むアデノウイルスベクター製剤 (ワクチン、遺伝子治療用製品等) を使用し
た者
① 本剤 2 回目接種時の抗 ChAdOx1 ベクター免疫が SARS-CoV-2 抗原に対する免疫に及ぼす影響につ
いて
申請者は、以下のように説明 した。
84
210