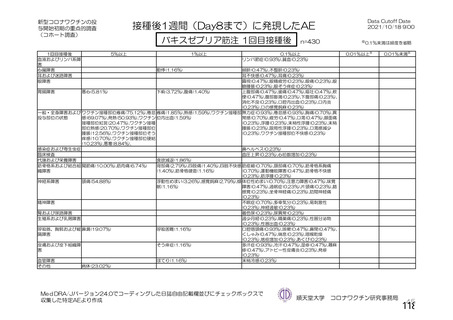
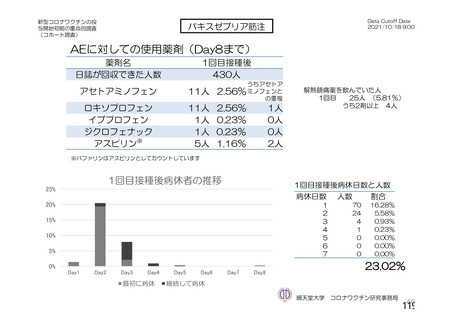
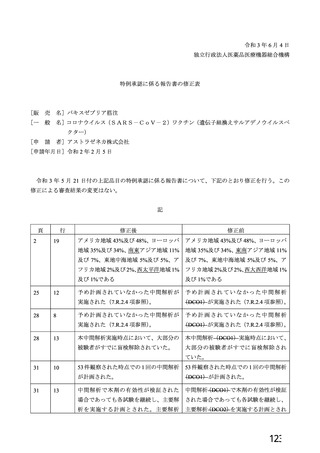
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (165 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
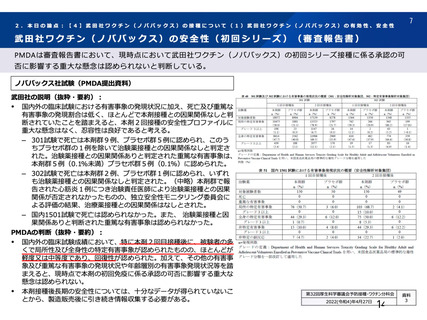
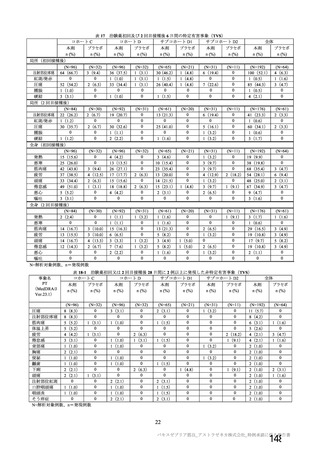
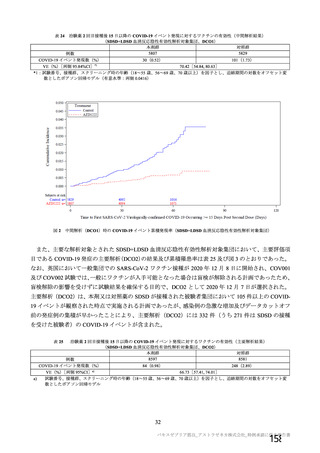
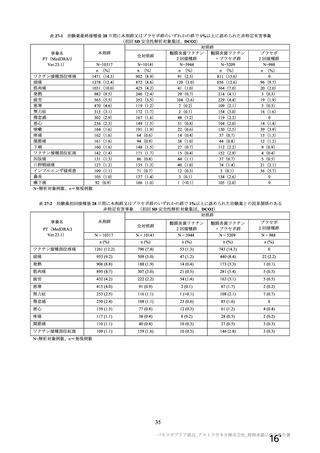
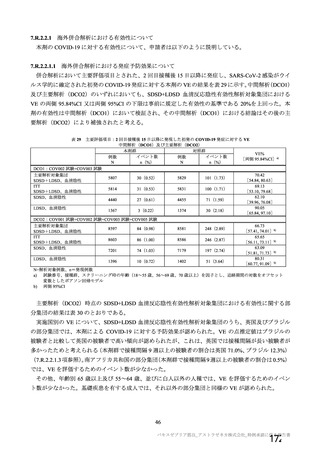
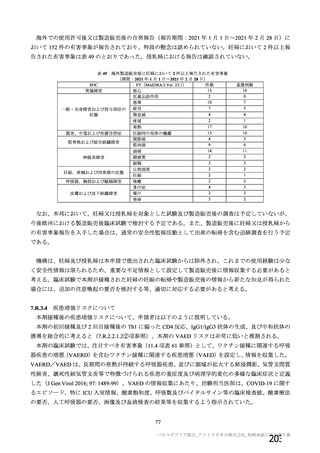
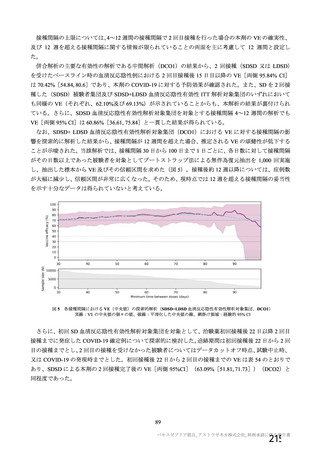
治験薬 2 回目接種後 28 日間に本剤群又はプラセボ群のいずれかの群で 1%以上に認められた治験薬との因果関係のある
非特定有害事象 (初回 SD 安全性解析対象集団、DCO2)
対照群
治験薬
本剤群
プラセボ
全対照群
髄膜炎菌ワクチン
2 回接種群
髄膜炎菌ワクチン
+プラセボ群
2 回接種群
N = 10317
N = 10141
N = 3944
N = 5209
N = 988
n (%)
n (%)
n (%)
n (%)
n (%)
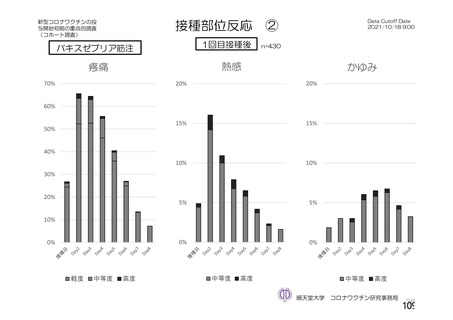
ワクチン接種部位疼痛
361 (3.5)
129 (1.3)
38 (1.0)
91 (1.7)
-
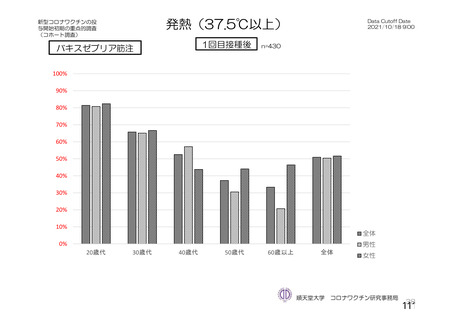
頭痛
189 (1.8)
140 (1.4)
34 (0.9)
93 (1.8)
13 (1.3)
筋肉痛
109 (1.1)
51 (0.5)
16 (0.4)
32 (0.6)
3 (0.3)
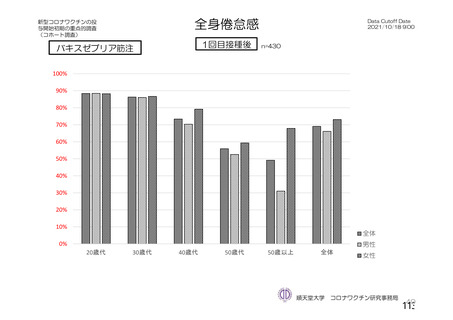
疲労
103 (1.0)
65 (0.6)
36 (0.9)
23 (0.4)
6 (0.6)
PT(MedDRA/J
Ver.23.1)
N=解析対象例数、n=発現例数
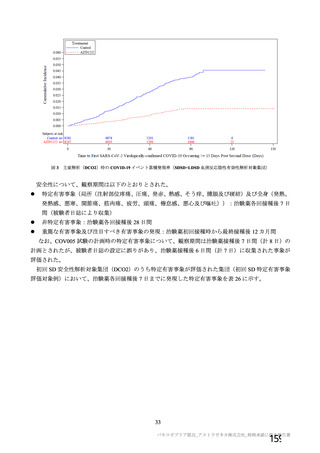
主要解析(DCO2)までに、死亡は本剤群 2 例(真菌性気道感染及び遠隔転移を伴う新生物)、対照群
5 例(COVID-19 肺炎、頭蓋脳損傷、損傷、殺人及び血液学的悪性疾患)に認められた。いずれも治験薬
との因果関係は否定された。試験の中止に至った有害事象は、本剤群 0 例、対照群 2 例に認められた。
重篤な有害事象は、本剤群 108/12,282 例(0.9%)、対照群 127/11,962 例(1.1%)に認められ、いずれ
かの群で 2 例以上に発現した事象は、虫垂炎(本剤群 6 例、対照群 7 例、以下同順)、憩室炎(3 例、0
例)、膵炎(3 例、0 例)、子宮付属器捻転(2 例、0 例)、狭心症(2 例、0 例)、子宮内膜症(2 例、
0 例)、出血性卵巣嚢胞(2 例、0 例)、椎間板突出(2 例、0 例)、半月板損傷(2 例、0 例)、腎盂腎
炎(2 例、0 例)、発熱(2 例、0 例)、腸の軸捻転(2 例、0 例)、腹痛(2 例、1 例)、自然流産(2 例、
1 例)、尿路結石(2 例、2 例)、COVID-19(2 例、17 例)、腎結石症(1 例、2 例)、心膜炎(1 例、
2 例)、急性心筋梗塞(0 例、2 例)、胆石症(0 例、2 例)、企図的過量投与(0 例、2 例)、毛巣嚢胞
(0 例、2 例)、交通事故(0 例、2 例)、敗血症(0 例、2 例)、小腸閉塞(0 例、2 例)、くも膜下出
血(0 例、2 例)、失神(0 例、2 例)、上肢骨折(0 例、2 例)、尿管結石症(0 例、2 例)、手首関節
骨折(0 例、2 例)、一過性脳虚血発作(0 例、3 例)、COVID-19 肺炎(0 例、4 例)であった。治験薬
との因果関係が否定されなかった重篤な有害事象は、本剤群 2 例(発熱及び横断性脊髄炎)(7.R.3.1.2
及び 7.R.3.2.2 参照)、対照群 2 例(自己免疫性溶血性貧血及び脊髄炎)に認められた。
7.R 機構における審査の概略
7.R.1
臨床データパッケージ及び審査方針について
COVID-19 の世界的な流行下において、迅速な SARS-CoV-2 ワクチンの開発が求められており、その
加速化のために ICMRA15)、WHO16)、各国の規制当局17)は開発についてのガイダンス等を公表してい
る。本邦では、令和 2 年 9 月 2 日に機構が「新型コロナウイルス(SARS-CoV-2)ワクチンの評価に関す
る考え方」(https://www.pmda.go.jp/files/000236327.pdf(最終確認日:2021 年 4 月 6 日))を公表し、臨
床試験に関して主に以下の考え方を提示している。
15) ICMRA statement on COVID-19: International regulators pledge collective support to combat COVID-19(http://www.icmra.info/drupal/
news/statement_on_COVID-19(最終確認日:2021 年 4 月 6 日))、ICMRA statement on clinical trials: International regulators provide gu
idance on prioritisation of COVID-19 clinical trials(http://www.icmra.info/drupal/news/statement_on_clinical_trials(最終確認日:2021 年 4
月 6 日))
16)「WHO R&D Blueprint; Target Product Profiles for COVID-19 Vaccines. WHO; 2020」及び「WHO R&D Blueprint; An international
randomised trial of candidate vaccines against COVID-19. WHO; 2020」
17)「Guidance for Industry: Development and Licensure of Vaccines to Prevent COVID-19. FDA; 2020、「EMA considerations on COIVD
-19 vaccine approval. EMA; 2020」等
36
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
162