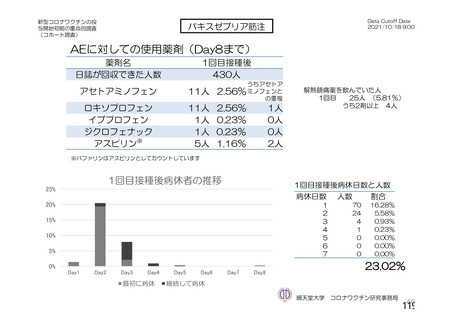
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (219 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
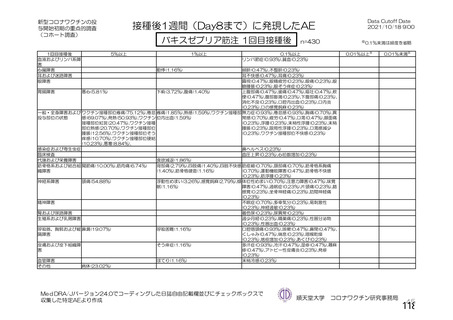
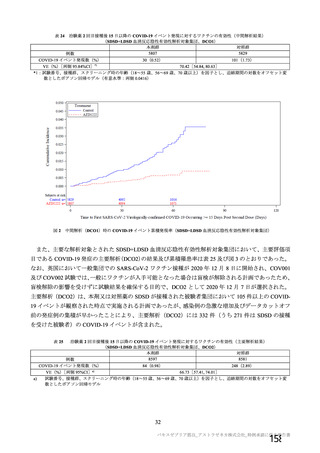
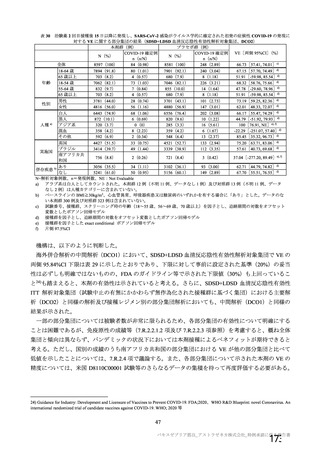
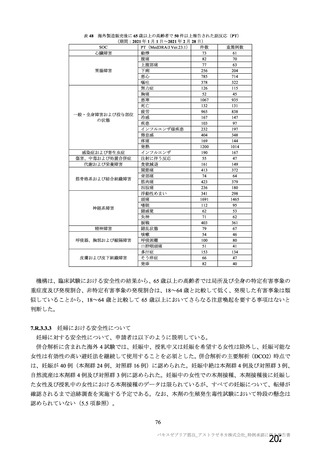
治験薬初回接種後 22 日以降 2 回目接種までの COVID-19 確定例に基づく VE
(初回 SD 血清反応陰性有効性解析対象集団、DCO2)
本剤群
対照群
9335
9312
例数
イベント数(%)
32(0.34)
82(0.88)
VE[両側95%CI]*1
60.99[41.37, 74.05]
*1:試験番号、接種群、スクリーニング時の年齢(18~55歳、56~69歳、70歳以上)を因子とし、追跡期間の対数をオフセット変
数としたポアソン回帰モデル
以上のことから、2 回目は 4~12 週間隔で接種可能と考えた。
機構は、以下のように判断した。
本剤の開発においては、パンデミックの状況下で、複数の臨床試験を同時に進行させ、得られた情報
に基づき本剤の用法・用量を含めて試験計画が随時変更されたことに加え、製剤の供給や物流に伴う制
限から、結果的に、併合解析において本剤の有効性の解析対象となった集団における接種間隔は本剤群
で 3~28 週と非常に幅広いものとなった。また、申請者及びオックスフォード大学は、本剤 2 回接種時
の接種間隔として当初 4 週を想定していたものの、併合解析では、本剤を 4 週以上の接種間隔で接種し
た際に接種間隔の延長に伴い VE が上昇する可能性が示唆されている。本来であれば、より最適化され
た接種間隔で本剤の有効性を検証するための試験を計画、実施すべきであったと考えるものの、パンデ
ミック下での開発に伴う上記のような制限を踏まえると、併合解析に含まれた一連の臨床試験の実施に
際して上記の方針を取ったことはやむを得ないものと考える。
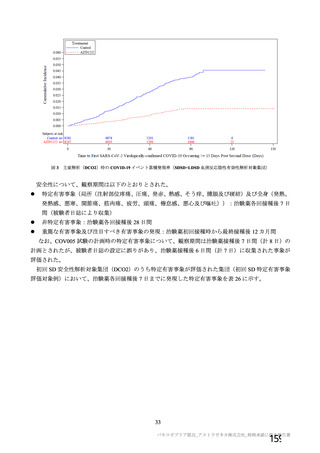
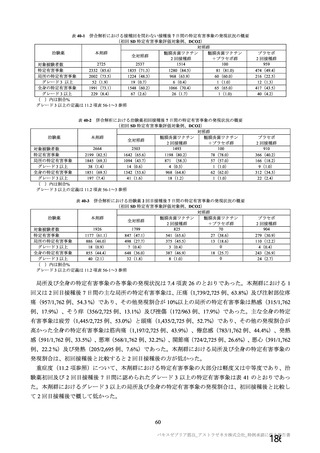
併合解析においては、上記のように様々な接種間隔で本剤を接種された被験者が存在しているものの、
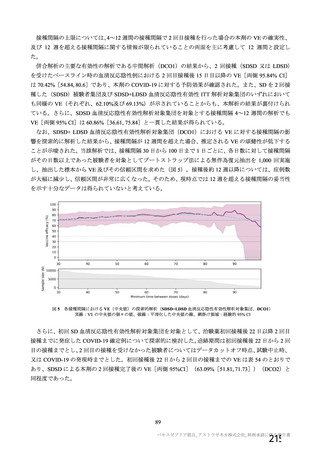
本剤群の約 82%の被験者において 4~12 週の接種間隔で接種されている(図 4)。さらに、有効性の主
要解析対象とされた SDSD+LDSD 血清反応陰性有効性解析対象集団に加えて、接種間隔 4~8 週及び 9
~12 週のいずれの部分集団においても本剤の有効性が示唆されていること(7.R.2.2.2 項参照)、国内
D8111C00002 試験の日本人被験者においても 4 週の接種間隔で本剤を接種することにより、併合解析の
接種間隔が 4~8 週の部分集団と同程度の中和抗体価が得られていること(7.R.2.2.1.3 項参照)、並びに
本剤を 4~12 週の接種間隔で接種された被験者集団における安全性及び忍容性について全体集団と比較
して大きな懸念は認められていないこと(7.R.3.1.3③項参照)を踏まえると、接種間隔の上限を 12 週と
した上で、接種間隔を「4~12 週」とすることは可能と考える。なお、今般のようなパンデミックの状況
下においてはできるだけ短期間に免疫を誘導することが好ましいと考えられることも踏まえると、12 週
を超える接種間隔を設定することについて適切性は見出せず、本剤については用法・用量に定められた
接種間隔の範囲で 2 回の接種を行うことが重要であると考える。
なお、国内 D8111C00002 試験で認められた中和抗体価は併合解析の接種間隔 4~8 週の部分集団の中
和抗体価と同程度であった一方で、併合解析において、探索的な結果ではあるものの接種間隔別の VE
の部分集団解析において接種間隔の延長に伴い VE が上昇する傾向が示唆されていること、中和抗体価
についても同様の傾向が認められること(7.R.2.2.2 項参照)等を踏まえると、本剤について最大の効果
を得るためには上限 12 週を超えない範囲で 8 週以上の間隔をおいて接種することが望ましいと考える。
7.R.6.3
接種対象年齢について
本剤の接種対象年齢について、機構は以下のように判断した。
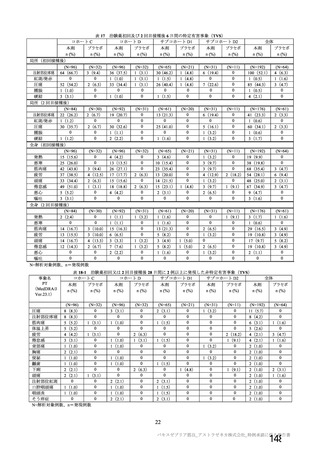
本剤の臨床データパッケージに含まれる臨床試験で組入れ対象とされた被験者の年齢は、国内
D8111C00002 試験で 18 歳以上、海外 COV001 試験で 18~55 歳、COV002 試験で 18 歳以上、COV003 試
90
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
216