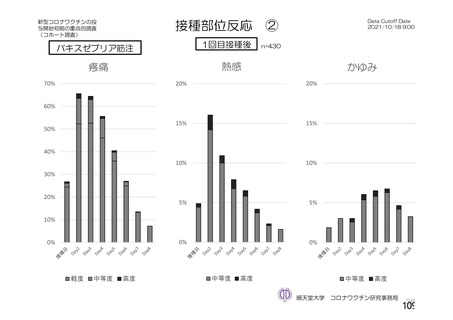
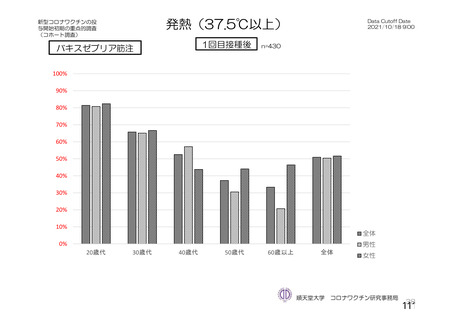
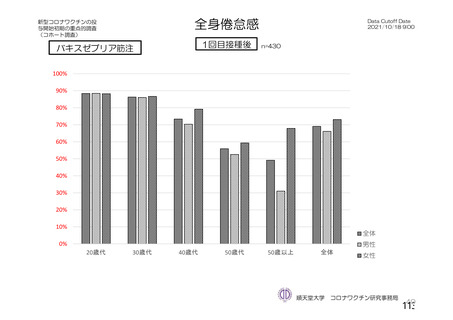
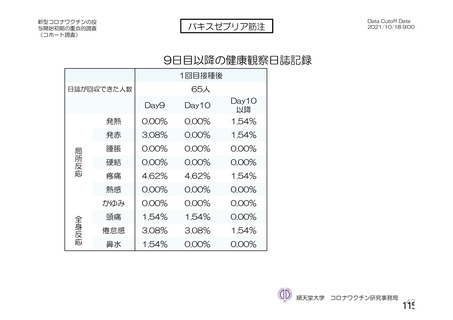
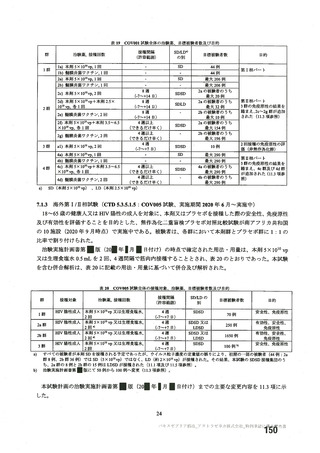
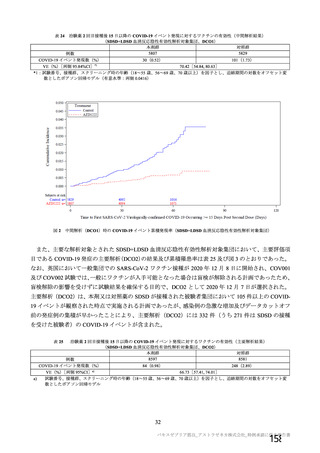
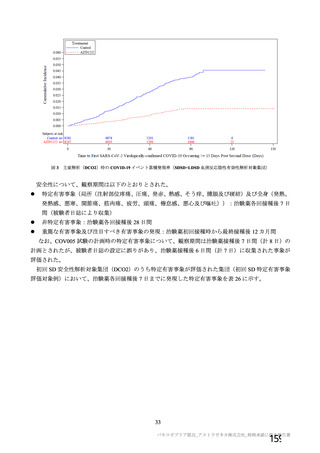
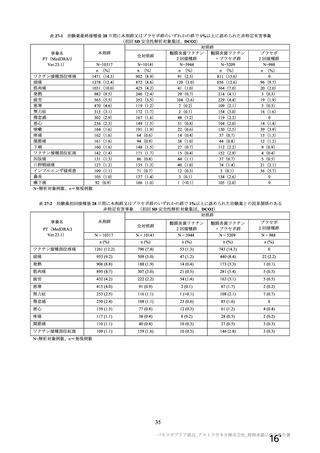
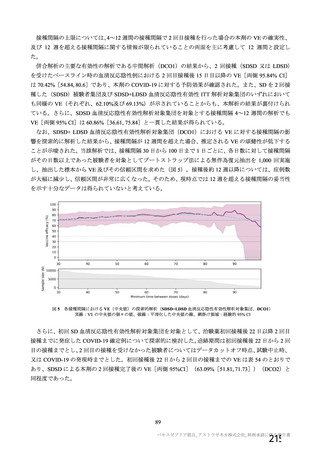
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
•
•
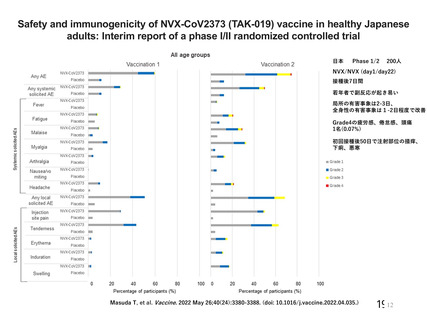
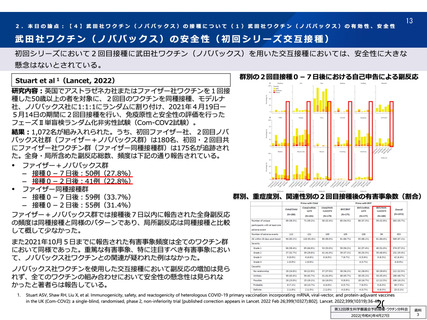
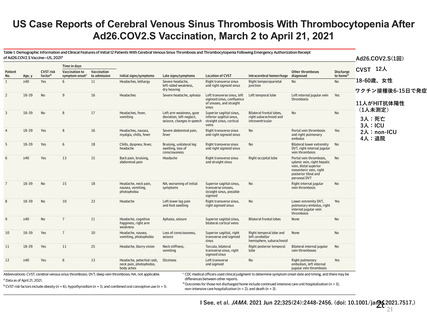
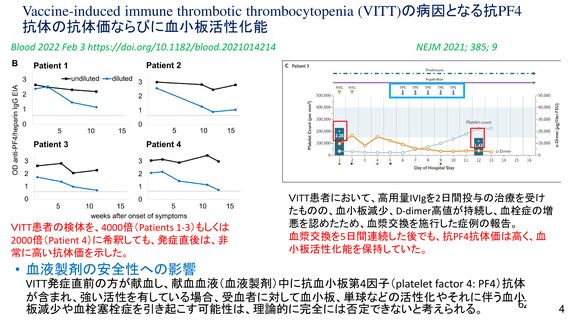
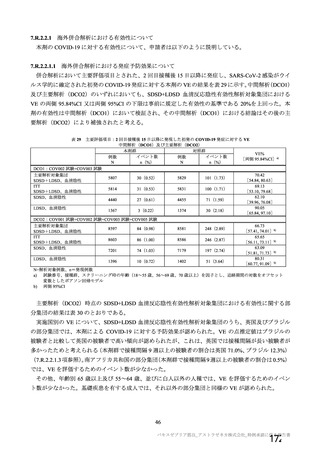
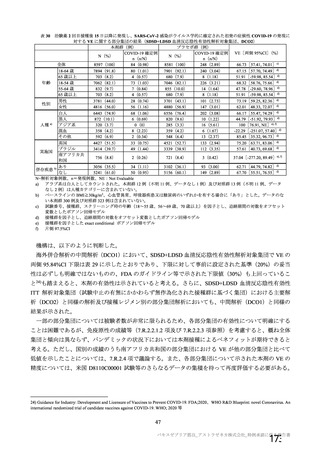
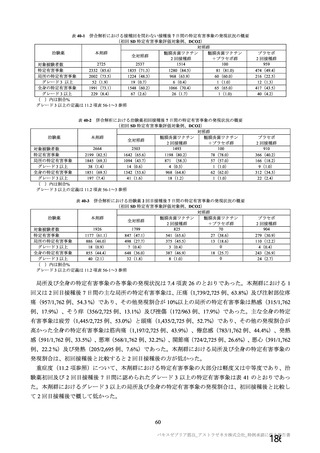
アストラゼネカ社製ウイルスベクターワクチンにおける特異的な有害事象であるVITT 発
症に係る免疫学的機序、無症候者に対する問診の限界、ならびに、血小板活性化能を
もつ抗PF4抗体が血液製剤に混入する可能性が排除できないことによる受血者の健康
(血液製剤の安全性)への影響等を総合的に勘案した結果、献血者ならびに血液製剤
の安全性を最優先に配慮すべきと考え、当該ワクチンの接種者については、接種後6週
間程度は採血制限期間を設けることが適切であると判断した。
血液確保への影響については、当該ワクチンの国内における接種の規模やペースが現
状程度であれば、軽微(0.1%未満)であると考えられる。
■原則
接種後6週間(42日)経過後
■接種後にVITTを発症した又発症が疑われる場合
当面は受入不可とする。
72
14