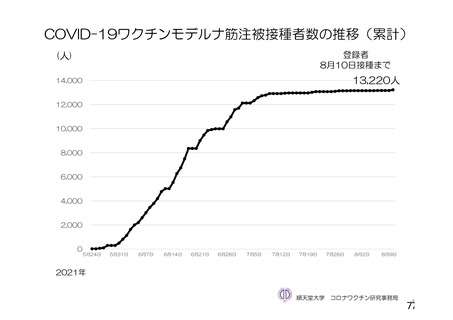
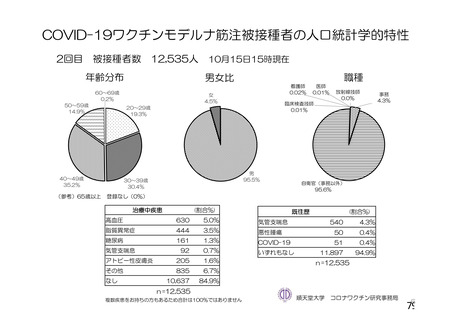
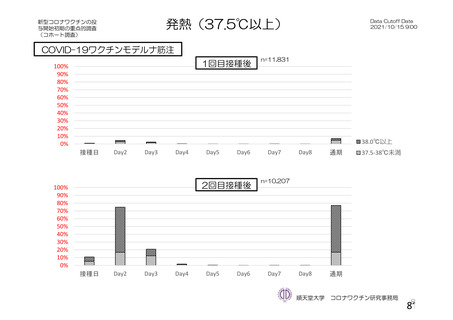
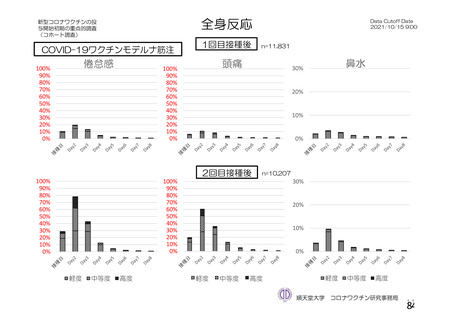
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (143 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
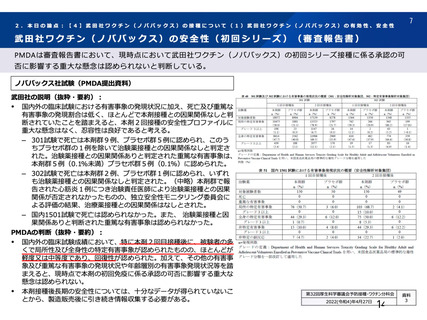
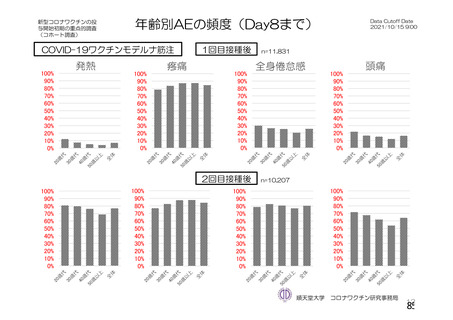
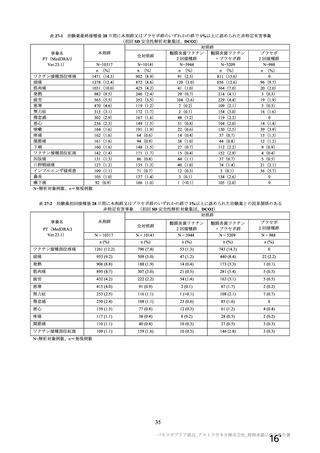
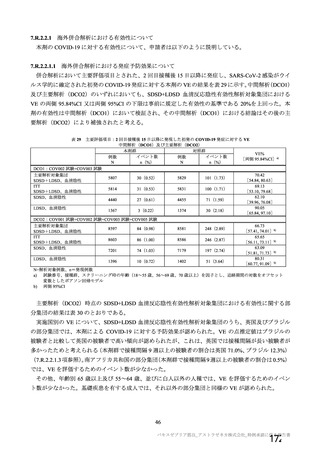
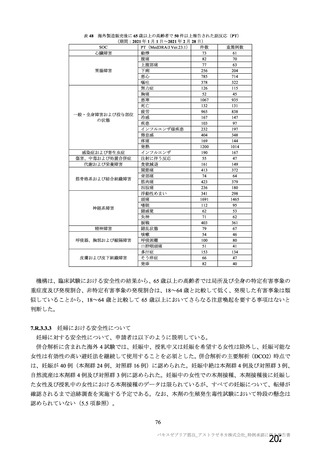
SARS-CoV-2 曝露後の肺の病理組織学的スコア
本剤群
SARS-CoV-2
曝露後の日数
項目
対照群
不活化
SARS-CoV-2 群
単回
単回投与
2 回投与
単回投与
2 回投与
5.0
12.0
2.0
3.0
8.0
6~7 日
[2.2, 7.8]
[10.6, 13.4]
肺の病理組織学的累積スコア a)
4.0
4.3
6.0
7.5
5.5
(平均値[両側 95%CI])
13~15 日
[3.1, 4.9]
[3.4, 5.6]
[3.6, 6.4]
[6.8, 8.2]
[3.5, 7.5]
a)
肺の病理組織学的スコア:気管支又は細気管支への滲出又は炎症性細胞の浸潤を伴う炎症、血管周囲への炎症性細胞の浸潤、
肺胞壁及び肺胞腔への炎症性細胞の浸潤を評価。
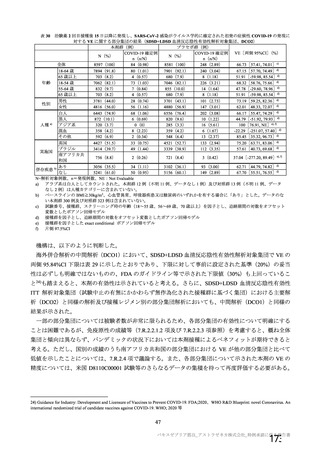
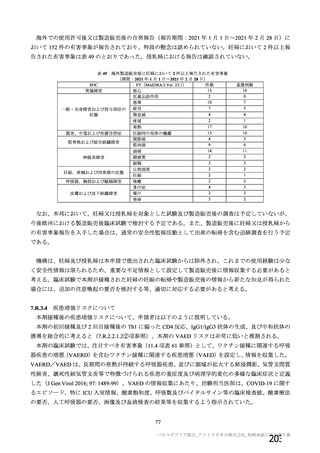
安全性薬理試験(CTD 4.2.1.3.1)
3.2
本剤投与による心血管系、呼吸器系への影響を評価する安全性薬理試験の概要は表 11 のとおりであっ
た。中枢神経系への影響は、マウスにおける反復筋肉内投与毒性試験(CTD 4.2.3.2.1)の中で評価され
た。申請者は、以下の結果を踏まえ、本剤投与による心血管系、呼吸器系、中枢神経系の生理機能への
影響は認められないと説明している。
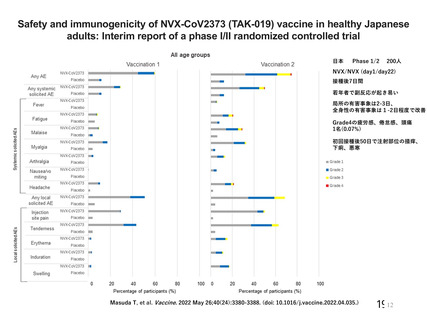
表 11
試験系
雄マウス
(CD-1)
(雄 6 例/群)
a)
試験系
評価項目
方法等
心血管系
血圧、心拍数、体温
安全性薬理試験成績の概略
用量
投与経路
(L/body)
添付資料
CTD
影響なし
0、70
呼吸器系
主な所見
a)
筋肉内
呼吸数、一回換気
量、毎分換気量等
4.2.1.3
影響なし
本剤(2.59×1010 vp /70 μL)
3.R 機構における審査の概略
提出された資料及び以下の検討により、機構は、本剤の非臨床薬理に特段の問題はないと判断した。
3.R.1
作用機序について
申請者は、本剤の作用機序について、以下のように説明した。
本剤は筋肉内接種後、接種部位周辺の細胞に感染し、感染細胞内で S タンパク質が発現すると考えら
れる。本剤の in vivo での検討では、本剤投与による SARS-CoV-2 に対する中和抗体の産生(マウス、ブ
タ、サル、フェレット)、IgG2a 及び IgG2b の増加(マウス)並びに IFN-γ 産生 CD8 陽性 T 細胞の増加
に認められる Th1 優位の免疫応答(マウス、ブタ)、並びに SARS-CoV-2 に対する一定の発症予防効果
が確認されている(サル、フェレット)。
以上の試験結果を踏まえると、本剤は、生体内で SARS-CoV-2 に対する中和抗体の産生、及び Th1 優
位の免疫応答(液性免疫及び細胞性免疫)を惹起し、SARS-CoV-2 に対する発症予防効果を惹起すると
考える。
機構は、申請者の説明を了承した。
3.R.2
SARS-CoV-2 変異株に対する中和活性の誘導について
機構は、本剤の開発以降に報告されている種々の SARS-CoV-2 変異株に対する本剤による中和活性の
誘導について説明を求め、申請者は以下のように説明した。
14
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
140