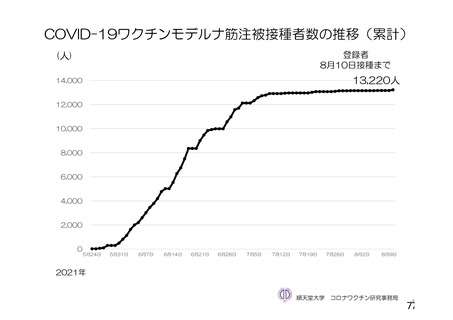
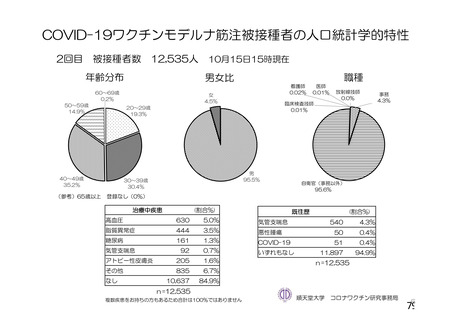
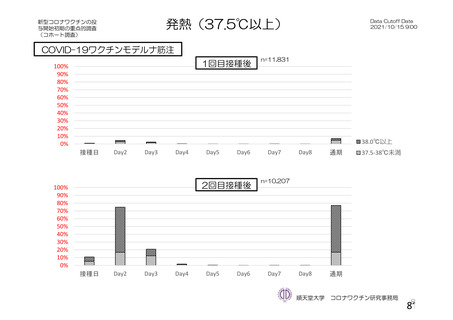
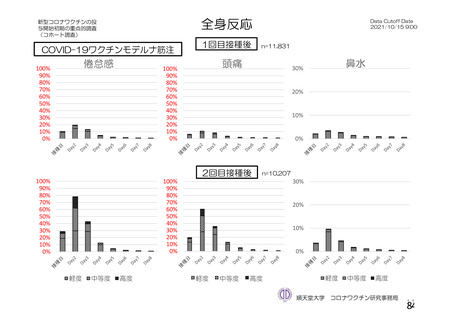
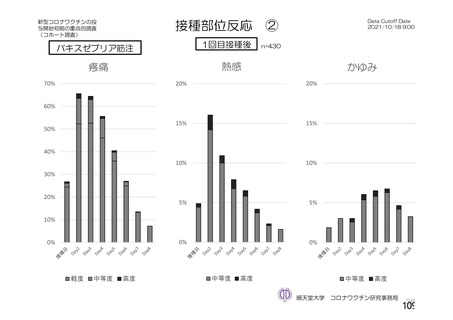
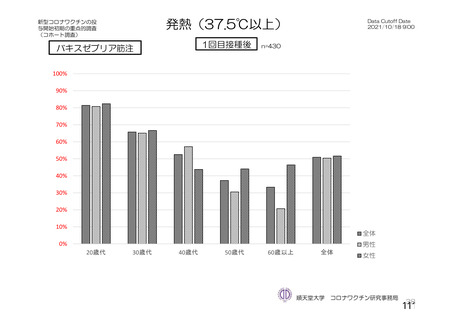
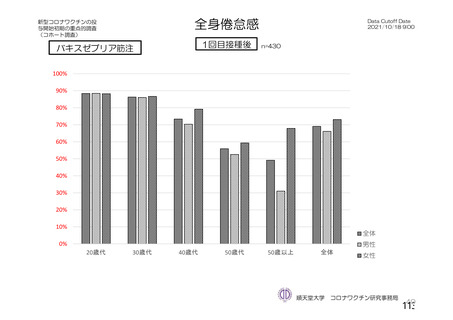
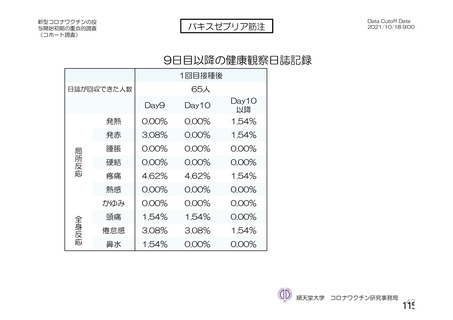
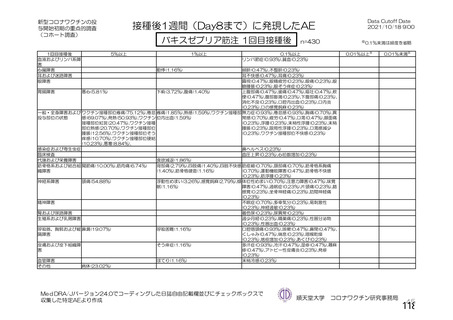
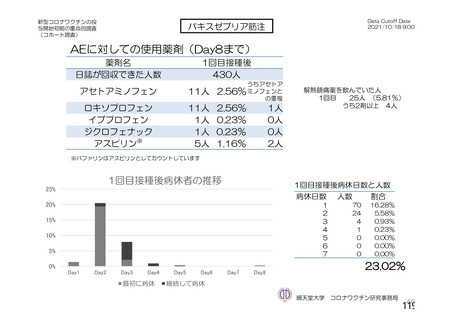
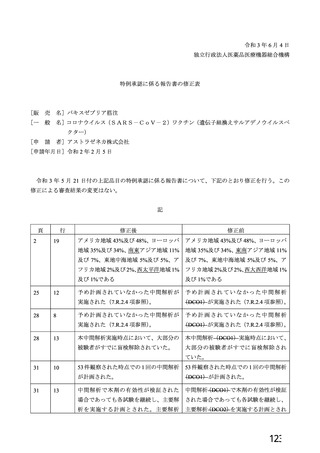
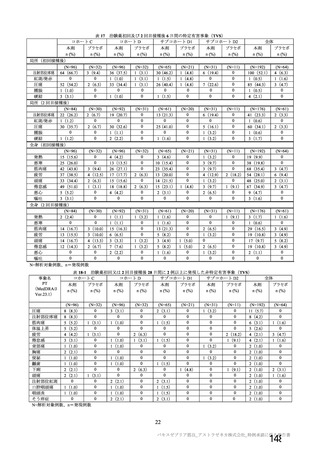
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (204 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
種者における本剤の安全性について、情報収集及び評価を継続する必要がある。
7.R.3.3.2
高齢者における安全性について
高齢者における安全性について、申請者は以下のように説明している。
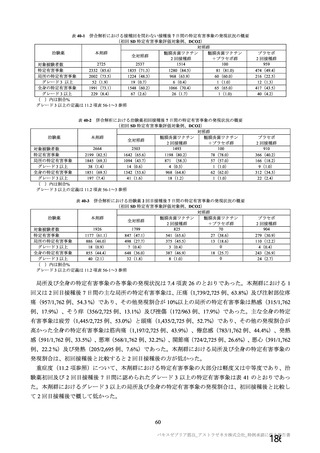
併合解析及び国内 D8111C00002 試験の結果、本剤の安全性プロファイルは高齢者と若年成人で概ね同
様であり、高齢者の方が有害事象の発現頻度が低かった(7.R.3.1.3 項参照)。
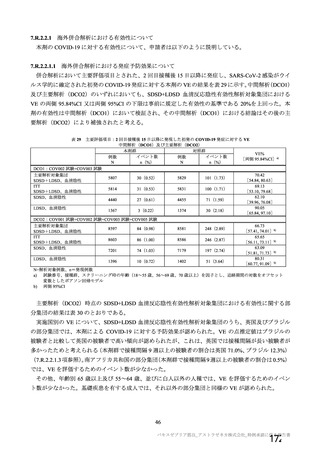
なお、併合解析に用いた 4 試験の全被験者数のうち、65 歳以上が全体の 9.4 %、70 歳以上が 6.4 %と、
高齢者の割合が少ないこと、及び高齢者は追跡期間が他の集団より短いことから、海外使用許可取得後
の安全性情報についても検討を行った。
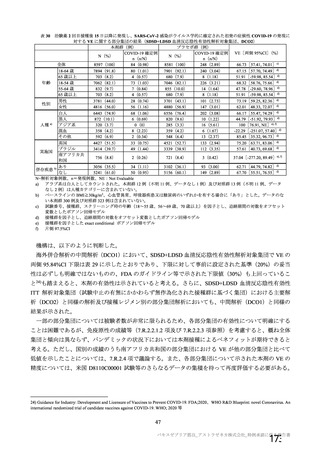
海外での使用許可後又は製造販売後の自発報告(報告期間:2021/1/1~2021/2/28)に基づくと、海外で
の承認後、高齢者において自発報告として有害事象が 14,303 件報告されており、主な副反応は表 48 の
とおりである。多くの報告は一般の被接種者から報告されたものであり、医学的確認がなされていない
こと、重篤性の定義も医学的確認がなされたものとは異なる可能性があること、及び高齢者の多くは既
存疾患を有していることも考慮すると、臨床試験において報告された安全性プロファイルと異なる傾向
は認められていない。
以上より、高齢者において非高齢者と比較して新たに安全性の懸念は認められておらず、現時点で高
齢者において特定された注意を要する事象はないと考える。
75
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
201