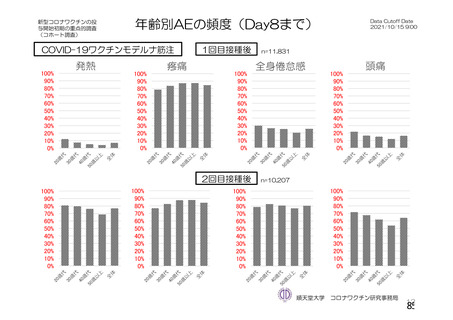
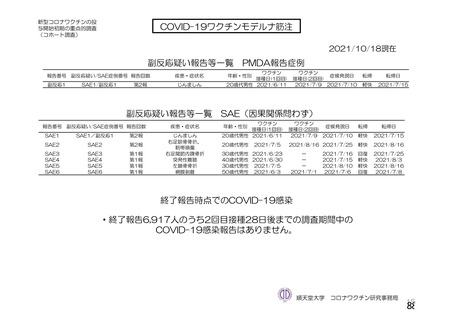
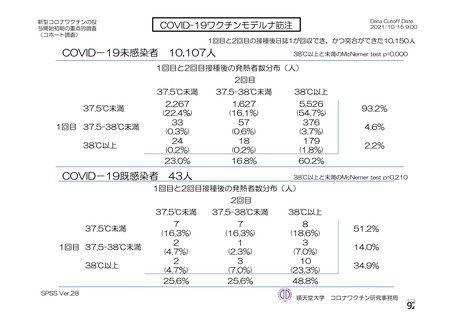
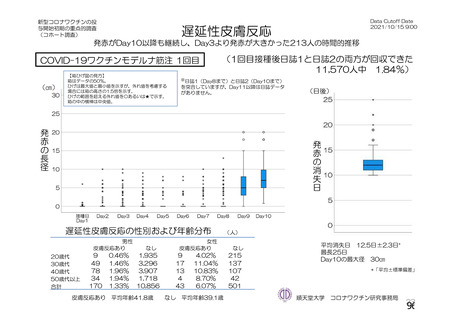
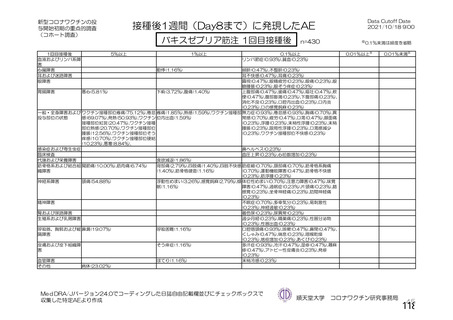
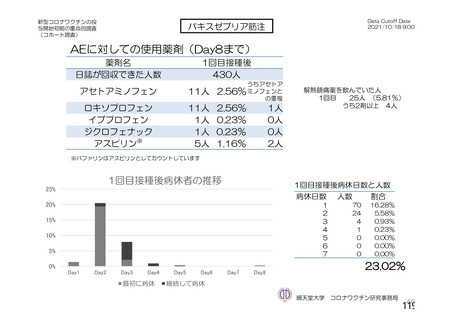
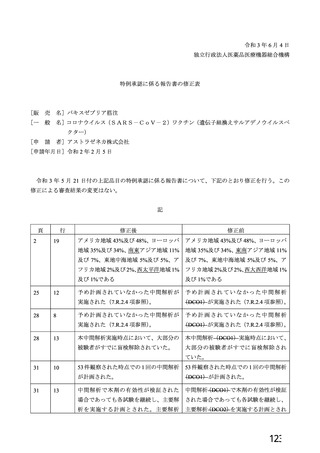
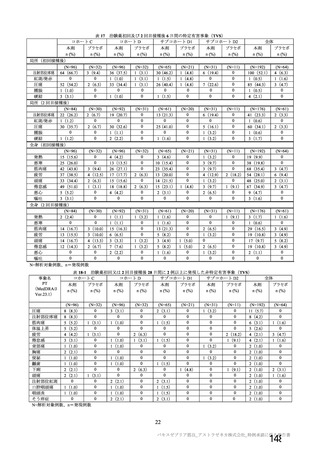
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (141 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
により SARS-CoV-2 に対する発症予防効果が認められたと説明している。
①
S タンパク質特異的 IgG 抗体及び中和抗体の検討(ELISA 法及び実ウイルスを用いた中和抗体分析
法)(CTD 4.2.1.1.2)
本剤の SARS-CoV-2 に曝露直前(単回投与又は 2 回投与後 28 日目)に、各群の血清を用いて、S
タンパク質特異的抗体並びに SARS-CoV-28)に対する中和抗体を測定した結果、本剤投与により、
いずれの抗体産生も認められた(表 7)。
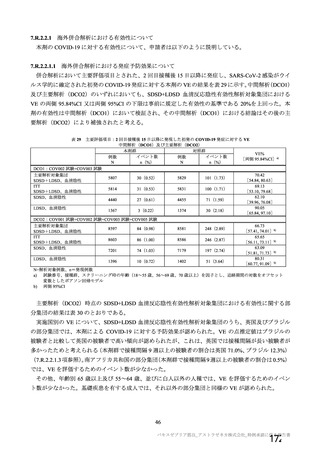
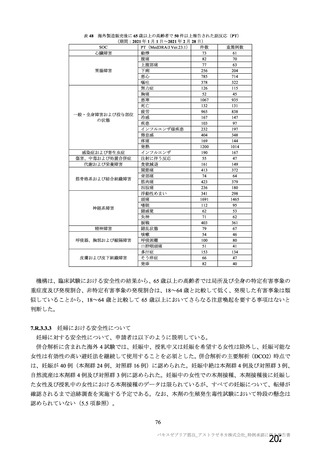
表7
本剤投与後 SARS-CoV-2 曝露直前の血清中 RBD 特異的 IgG 抗体及び中和抗体
RBD 特異的 IgG 抗体価
中和抗体価
群
GMT[両側 95%CI]
GMT[両側 95%CI]
単回投与群
955[447, 2041]
15[9,26]
2 回投与群
4365[1698, 11482]
52[24,115]
50
3
対照群
②
末梢血単核球におけるサイトカイン産生の検討(ELISpot 法及び細胞内サイトカイン染色法)(CTD
4.2.1.1.2)
本剤の単回投与又は 2 回投与後 28 日目に、各群の動物を SARS-CoV-2(2.6×106 TCID50)で鼻腔
内、気管内、口腔内又は眼内曝露し、曝露後 1~7 日目に動物から採取した末梢血単核球を S タンパ
ク質全長で刺激した結果、本剤群では曝露後 1 日目に IFN-の増加が認められた。一方、TNF-、IL2、IL-4、IL-5、IL-6、IL-10、及び IL-13 では、本剤群と対照群(ChAdOx1 GFP 投与群)に差異は認
められなかった。
③
SARS-CoV-2 曝露後の発症予防効果の検討
1)
ウイルス RNA 残存、臨床徴候、肺の病理組織学的所見(CTD 4.2.1.1.2)
本剤の単回投与又は 2 回投与後 28 日目に、各群の動物を SARS-CoV-28)(2.6×106 TCID50)で鼻
腔内、気管内、口腔内又は眼内曝露した結果、ウイルス RNA 残存、肺の病理組織学的所見及び臨床
徴候スコアは表 8 のとおりであった。
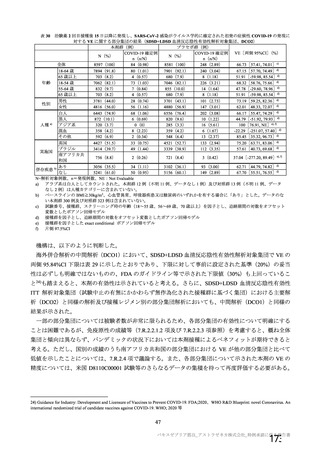
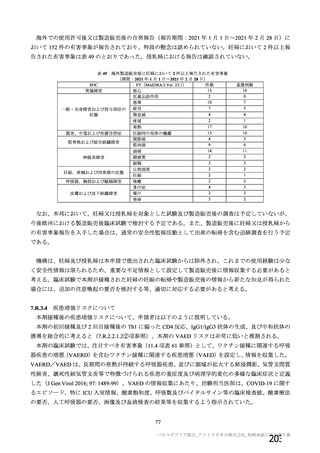
表 8 SARS-CoV-2 曝露後のウイルス RNA 残存、肺の病理組織学的所見及び臨床徴候スコア
評価項目
本剤群(単回投与)
本剤群(2 回投与)
対照群 a)
ウイルス RNA 残存(気管支肺 気管支肺胞洗浄液:
気管支肺胞洗浄液:
気管支肺胞洗浄液:
3 日目 1/6 例、
胞洗浄液及び肺組織)b)
3 日目 1/6 例、
3 日目 6/6 例、
5 日目 0/6 例
5 日目 0/6 例
5 日目 5/6 例
肺組織:
肺組織:
肺組織:
7 日目 2/6 例
7 日目 2/6 例
7 日目 6/6 例
肺の病理組織学的所見 d)
0/6 例
0/6 例
2/3 例 e)
c)
3 日目 7.5 [5.0, 10.0]
、
3 日目 8.8 [7.3, 10.3]
、
3 日目 12.5 [10.8, 14.2]、
臨床徴候スコア
(平均値[両側 95%CI]
)
5 日目 1.8 [0.3, 3.4]、
5 日目 6.3 [3.5, 9.1]、
5 日目 9.3 [6.9, 11.7]、
7 日目 2.0 [0.9, 3.1]
7 日目 7.5 [5.8, 9.2]
7 日目 9.5 [6.6, 12.4]
a) 対照群:ChAdOx1 GFP 投与群
b) ウイルス RNA:ウイルス曝露後 3 及び 5 日目に気管支肺胞洗浄液、7 日目に肺組織を採取し、gRNA 陽性例を評価。
c) 臨床徴候スコア:SARS-CoV-2 曝露後、全身状態、皮膚及び被毛の状態、分泌物、呼吸、糞及び尿の状態、食欲並びに活動性を
評価。
d) ウイルス曝露後 7 及び 13 又は 14 日目に採取し、肺障害が認められた例数を評価。
e) ウイルス性間質性肺炎が認められた。
2)
ウイルス RNA 残存、肺の病理組織学的所見及び CT スコア(CTD 4.2.1.1.4)
12
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
138