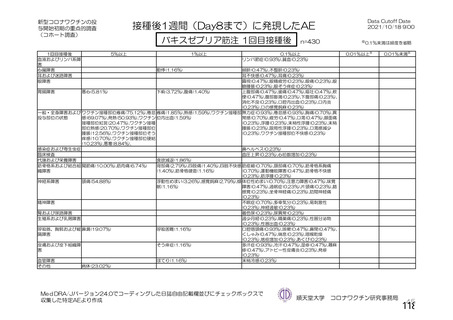
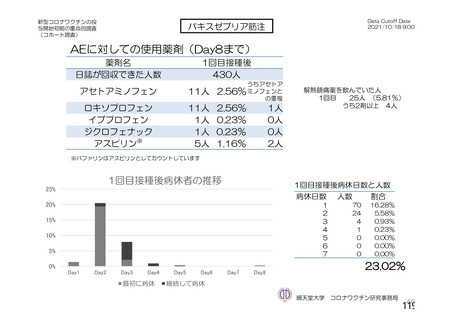
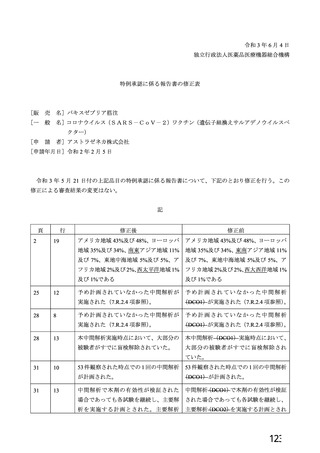
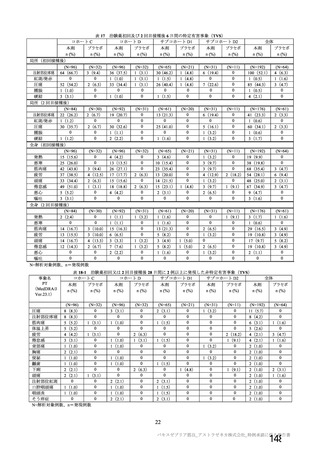
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (174 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
動的な検体採取が本剤の有効性評価に影響を与えた可能性は低いと考える。
機構は、主要評価項目について、以下のように判断した。
「新型コロナウイルス感染症に係るワクチンの接種について(令和 3 年 2 月 9 日内閣官房厚生労働
省)」(https://www.cas.go.jp/jp/seisaku/ful/bunkakai/wakuchin_sesyu.pdf(最終確認日:2021 年 4 月 6 日))
によると、SARS-CoV-2 ワクチンの接種目的は「新型コロナウイルス感染症の発症を予防し、死亡者や
重症者の発生をできる限り減らし、結果として新型コロナウイルス感染症のまん延の防止を図る」こと
とされている。現在の SARS-CoV-2 パンデミックの状況を考えると、公衆衛生上は COVID-19 の発症を
予防することが重要であり、発症数を抑制することで重症者数の抑制にもつながるものと考えられる。
したがって、併合解析の主要評価項目を、症候性 COVID-19 の発症予防効果としたことは妥当であった
と考える。なお、重症化予防効果については副次評価項目として検討されていることから、7.R.2.3 項に
おいて確認する。
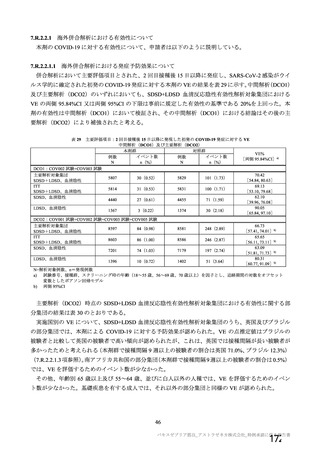
主要評価項目について、COVID-19 イベントの定義は、国際的なガイドライン等の推奨状況と大きく
異ならず、本剤の有効性を評価するにあたり大きな問題はなかったと考える。また、評価期間について
も、現時点で本剤の発症予防効果を評価するにあたり 15 日が最適かは明らかではないものの、WHO の
ガイドラインにおいて複数回接種のワクチンの場合は最終接種後 14 日超以降の VE を評価する旨記載
されていること23)も踏まえると、2 回目接種後 15 日以降と設定した申請者の計画について一定の理解は
可能と考える。
SARS-CoV-2 感染のウイルス学的な診断に複数の核酸増幅検査法を用いたことについて、本来であれ
ば検査方法を統一する、中央検査を行う等の対応をとるべきであったが、パンデミック下に早急にワク
チン開発を進める必要があった海外試験開始時に検査体制が十分確立されていなかった状況では実施上
やむを得ず、各検査の感度及び特異度等も踏まえると、本剤の有効性を評価する上で大きな問題とはな
らないものと考える。
COVID-19 発症の確定診断のためのウイルス学的検査を行うトリガーとなる症状の定義は、原則とし
て試験の途中で変更するべきではないと考えるが、COVID-19 の疫学情報や病態に関する知見の集積に
伴い、トリガーとすべき症状の定義を変更せざるを得なかった状況は理解可能である。さらに、いずれ
の試験も盲検下で同時対照が存在する状況であり、また、各症例は、SARS-CoV-2 感染の確認及び盲検
下のエンドポイント判定委員会による確認がなされた上で、主要評価項目に合致するイベントとして集
計された。加えて、組入れ開始後に症状の定義が変更されたのは COV001 試験のみであり、その変更も
組入れ開始直後であったことを踏まえると、有効性の評価において影響はほとんどないものと考える。
また、ウイルス学的検査を実施するための検体採取方法に受動的な検体採取と能動的な検体採取が混在
したことについて、能動的な検体採取では、ウイルス学的検査対象のトリガーとなる症状を有さない場
合にもウイルス学的検査が実施されるものの、最終的に主要評価項目に係るイベントに合致した症例と
して集計されるのは、定義された症状のある場合に限られるため、有効性の評価において影響はほとん
どないものと考える。
7.R.2.2
有効性の結果について
23) WHO R&D Blueprint: novel Coronavirus. An international randomized trial of candidate vaccines against COVID-19. WHO; 2020
45
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
171