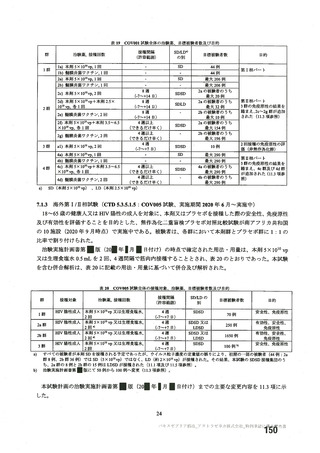
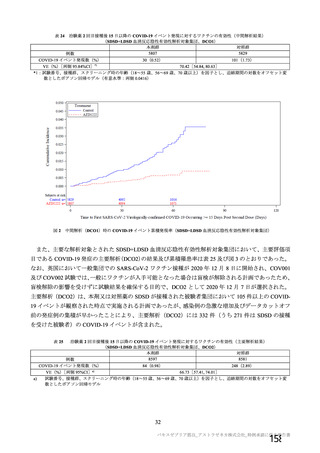
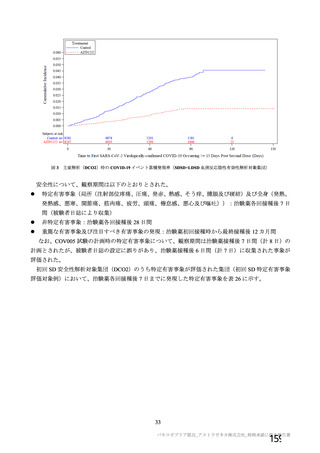
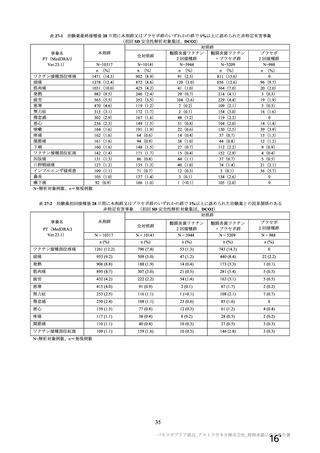
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (63 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
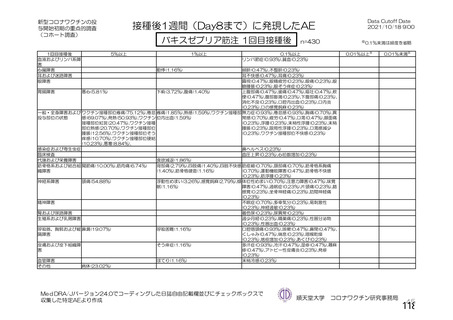
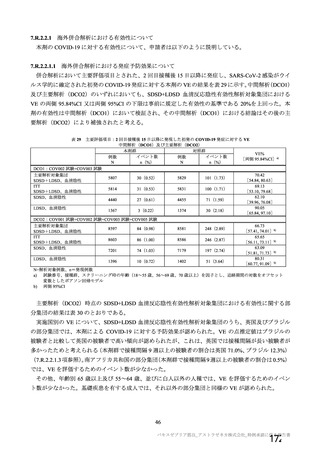
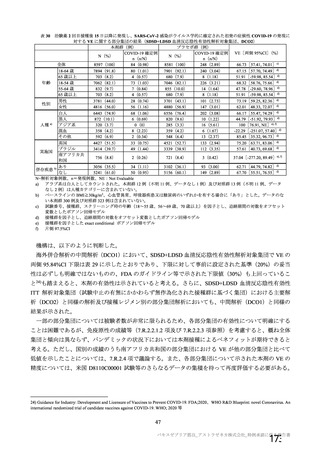
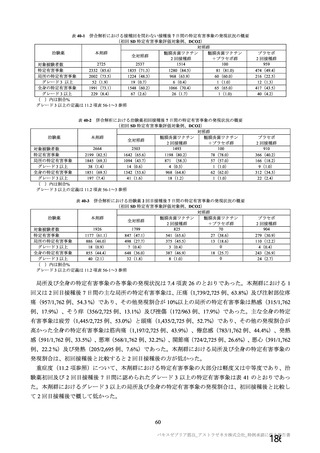
チン接種者の採血制限期間の検討にあたっての考慮すべき点
• 「献血者の安全性」
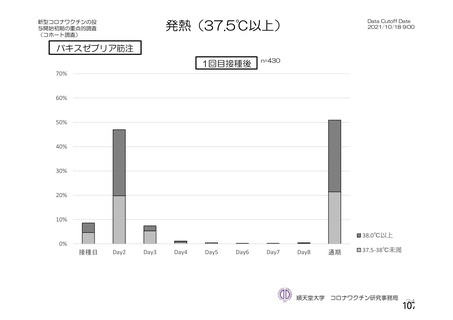
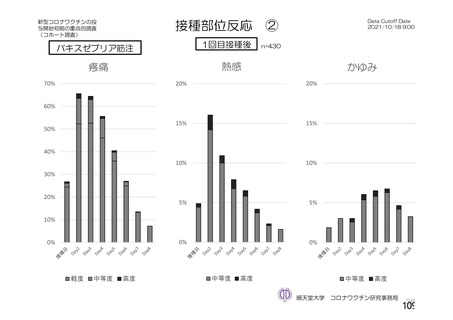
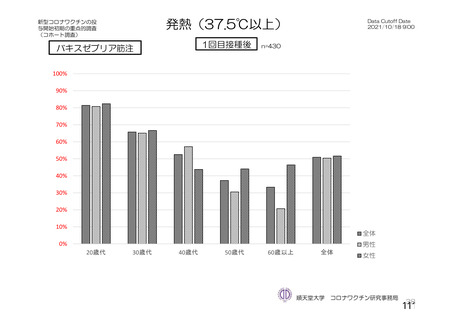
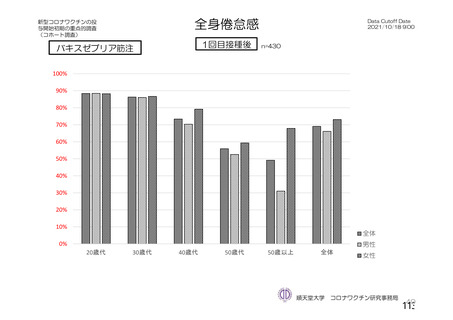
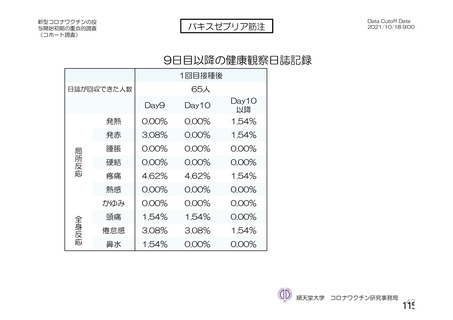
「バキスゼブリアの添付文書」、「バキスゼブリア筋注適正使用ガイド」では、当該ワク
チン接種後の副反応は接種後28日目までに発症するとされている。
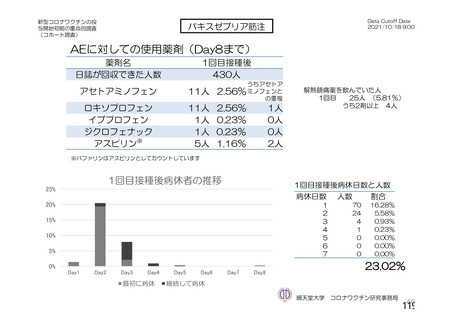
• 「血液製剤の安全性」
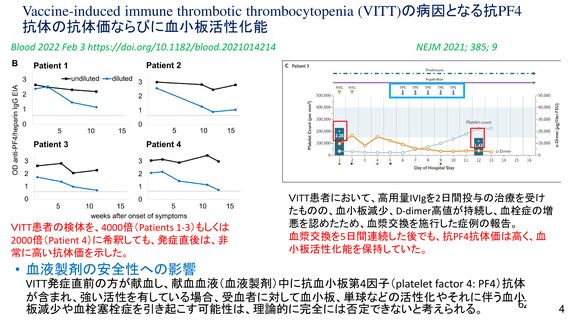
アストラゼネカ社製ワクチン接種後の重篤な有害事象として、当該ワクチンの接種に
より誘導された免疫応答による血栓性血小板減少症(vaccine-induced immune
thrombotic thrombocytopenia: VITT)があり、これを引き起こす抗PF4抗体が血液製剤
の安全性に与える影響を考慮する必要がある。
• 「血液確保への影響」
アストラゼネカ社製ワクチンは、本邦において接種者が非常に少ないことに加え、対
象者が限定されている(mRNAワクチンの接種が適さない方など)。
「献血者の安全性」や「血液確保への影響」に加え、本ワクチン固有の特性を踏まえ、「血液製剤
の安全性」への影響にも着目し、慎重に採血制限期間を検討する必要があると考える。
60
2