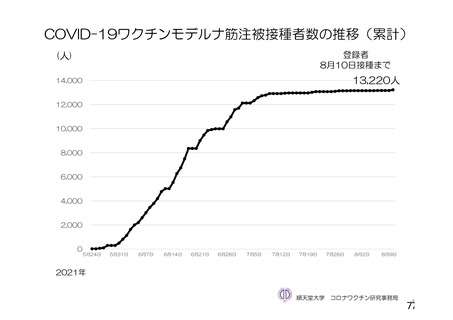
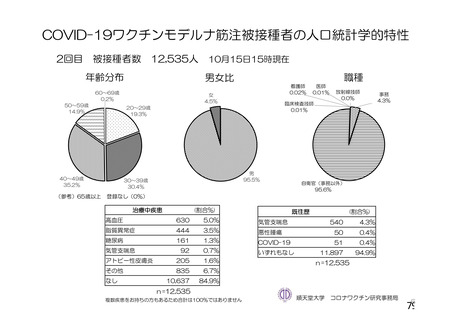
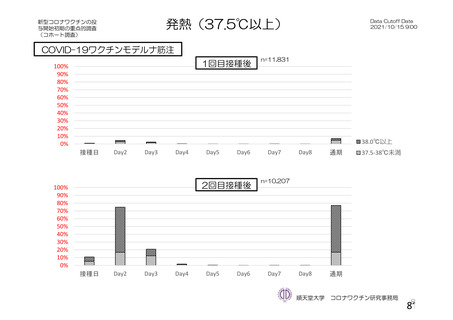
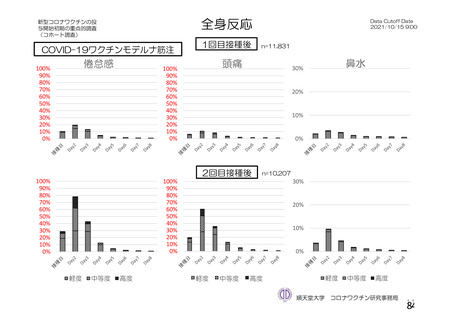
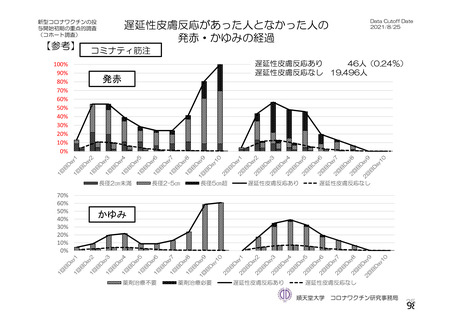
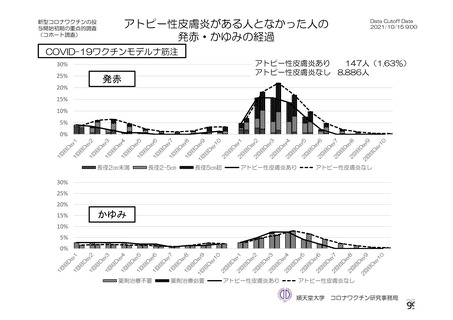
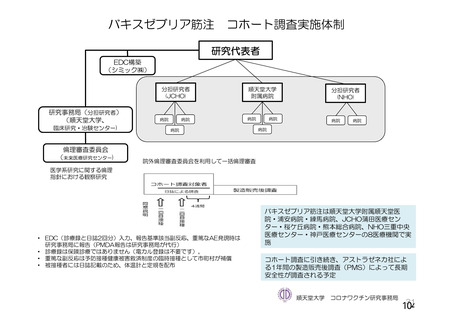
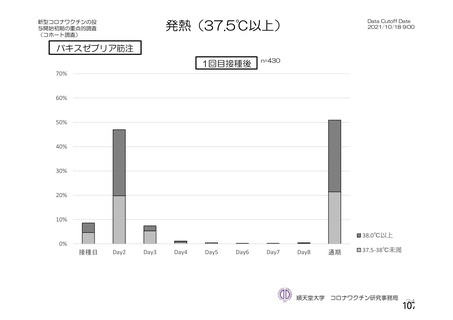
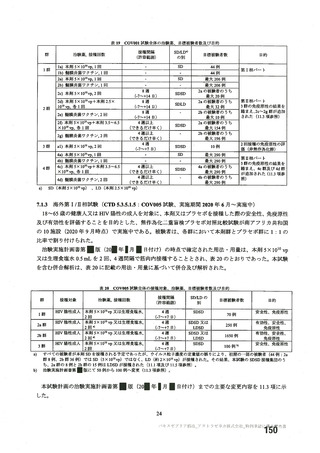
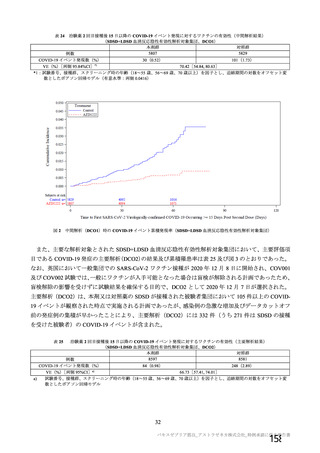
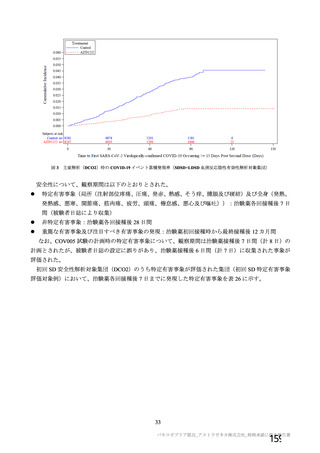
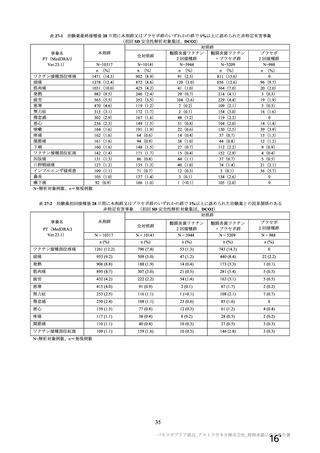
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (196 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
められた。被験者は発疹及び息切れを発現し、低血圧又は気道の問題は認められず、アドレナリン及び
クロルフェニラミンの筋肉内投与による治療を受け同日回復した。当該事象発現時、被験者は抗生物質
による扁桃炎の治療を実施中であった。また、事前に規定した注目すべき有害事象には含まれないもの
の、本剤群では、初回接種 8 日後に非重篤なグレード 2 の血管浮腫が 1 例認められた。本事象はカニを
摂取した後に発現し、同日回復した。
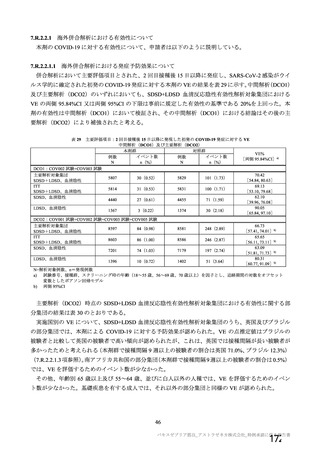
本剤の安全性データベース(臨床、自発的及び非自発的報告並びに文献)において、海外製造販売後
(国際誕生日:2020 年 12 月 29 日(英国))2021 年 2 月 5 日までに本剤と関連のあるアナフィラキシー
反応(狭義)及び血管浮腫(狭義)(いずれも SMQ)、並びに過敏症(PT 基本語)で収集された事象は
75 例 85 件であった。11 例が非重篤、64 例が重篤であった。死亡例はなかった。平均年齢は 46 歳(範
囲:18~90 歳)であり、71 例が女性、4 例が男性であった。
75 例中 14 例でアナフィラキシー反応が報告された。うち 7 例が Sampson 基準(J Allergy Clin Immunol
2006; 117: 391-7)に合致しており、6 例が 28~60 歳の女性であった。発症時期は、ワクチン接種日(5
例)又は接種翌日(2 例)であった。Sampson 基準に合致しなかった 7 例は Sampson 基準に合致する十
分な情報はなかったものの、本剤接種との因果関係は否定されなかった。75 例のうち残りの 61 例は、
情報が限られる、及び/又は他に原因のある可能性がある、又は発現時期を踏まえると急性過敏反応には
該当しない事象であった。61 例中 48 例は、Sampson 基準に合致するアナフィラキシーと判断できる情
報がなかった。
ショック又は循環虚脱が 3 例報告され、すべて女性であった。発症時期はすべて 0~1 日以内で、転帰
は軽快 2 件、未回復 1 件で、全例が重篤であった。本剤接種との因果関係は否定されなかった。
75 例中 33 例で血管浮腫又は局所腫脹が報告され、その内訳は、血管浮腫 7 例、口唇腫脹 7 例、顔面
腫脹 6 例、舌膨張 6 例、眼部腫脹 5 例、咽頭腫脹 4 例、口腔腫脹 2 例及び眼窩周囲腫脹 2 例であった。
33 例のうち 27 例は接種後 2 日以内の発現であり、残りの 6 例は発現日までの期間が得られていない又
は接種 4 日後の発現であった。血管浮腫 7 例のうち 4 例は接種後 24 時間以内の発現であり、21~73 歳
の女性であった。これらの 7 例はすべて重篤で、1 例は生命を脅かす事象であった。
なお、海外製造販売後(国際誕生日:2020 年 12 月 29 日(英国))2 月 28 日までの情報に基づくと、
アナフィラキシーに関連する報告は 522 件(ショック、ショック症状及び循環虚脱 18 件を含む)、この
うち重篤例は 408 件であった。
重篤な過敏症/アナフィラキシー反応については本剤接種との間に合理的な因果関係が否定できず、
本剤の重要な特定されたリスクであると考えるため、添付文書等において、本剤の成分によってアナフィ
ラキシーを呈したことがあることが明らかな者には本剤を接種すべきでないこと、及び接種に際しては
アナフィラキシー様症状に対し適切な処置のとれる準備をすることを注意喚起する。
機構は、ショック・アナフィラキシー等の免疫反応について、臨床試験及び海外製造販売後における
発現状況を確認し、これらについて本剤の重要な特定されたリスクとして、添付文書で注意喚起すると
の申請者の説明を了承した。また、本剤の接種前には、被接種者の既往歴等を確認し、接種後一定時間
は被接種者の観察を行うことが望ましく、異常が認められた場合には適切な処置を行う必要がある旨に
ついても情報提供する必要があると考える。
67
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
193