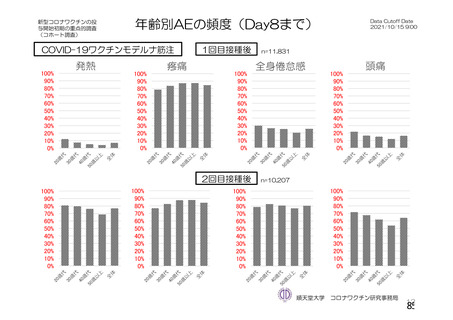
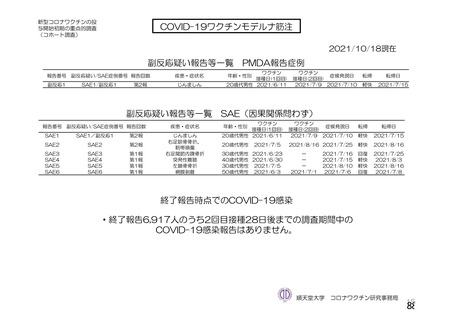
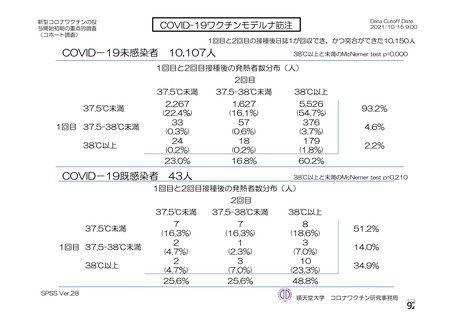
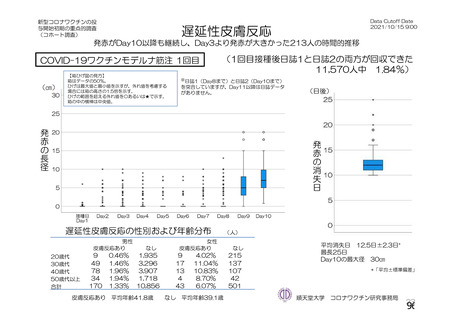
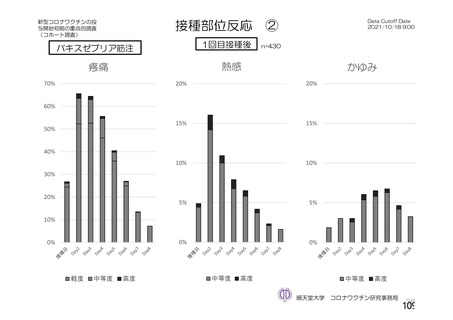
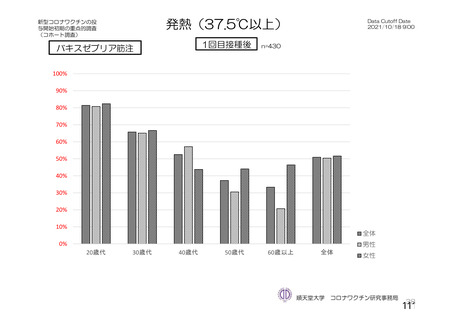
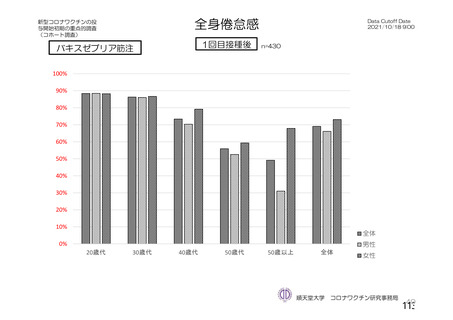
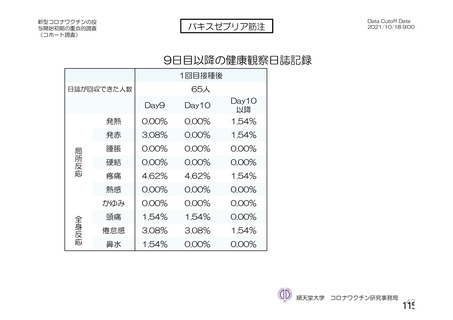
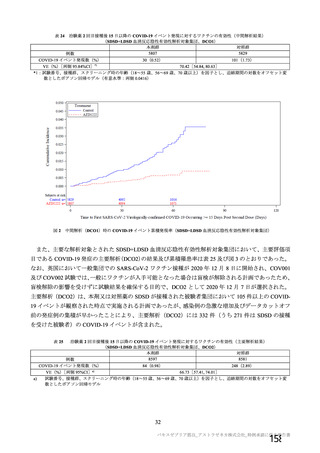
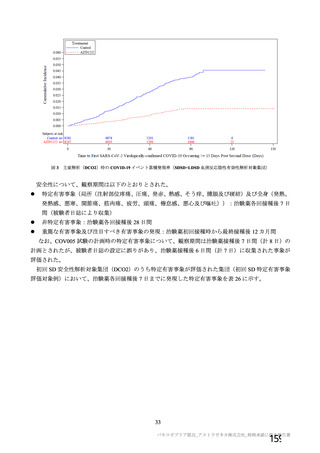
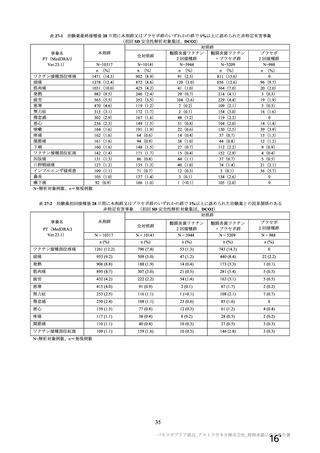
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (138 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
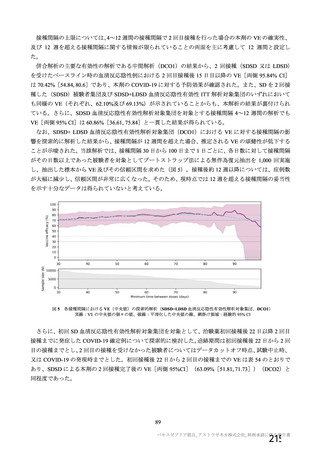
機構は、現時点までに提出された資料及び以下の検討から、本剤の非臨床試験・臨床試験成績の評価
に影響を及ぼすような重大な品質上の問題はないと判断した。なお、実施中の原薬及び製剤の長期保存
試験の成績については申請者に速やかな提出を求めており、審査結果を報告(2)に記載する。
2.R.1
原薬及び製剤の有効期間について
申請者は、本剤の有効期間について、海外における設定と同様に、原薬は-90℃~-55℃で保存する
とき 6 カ月、製剤は 5±3℃で保存するとき 6 カ月と設定し、以下のように説明している。
製法 c と製法 d で製造された原薬について、品質試験の成績から同等性/同質性は示されている。
原薬の有効期間について、製法 c 及び製法 d で製造された原薬(それぞれ 3 ロット及び 6 ロット)の
長期保存試験(いずれも-90℃~-55℃及び 5±3℃)は継続中であるが、製法 c で製造された原薬の 4
カ月時点及び製法 d で製造された原薬の 2 カ月時点までの主な品質特性(性状、pH、感染価、ウイルス
粒子濃度、ウイルス粒子:感染性ウイルス粒子比等)に大きな変化は認められていない。なお、製法 c 及
び製法 d で製造された原薬の長期保存試験は、12 カ月までデータを取得する予定である。
製剤の有効期間について、製法 C で製造された製剤 3 ロットの長期保存試験において、6 カ月時点ま
での主な品質特性(性状、pH、感染価、ウイルス粒子濃度、ウイルス粒子:感染性ウイルス粒子比等)
に大きな変化は認められていない。また、製法 D で製造された製剤の長期保存試験成績は現時点におい
て得られていないものの、製法 C と製法 D で製造された製剤の品質試験の成績による同等性/同質性か
ら、製剤の有効期間を 6 カ月と設定することは可能と考える。なお、製法 D で製造された製剤について
長期保存試験を継続中であり、12 カ月までデータを取得する予定である。
機構は、現時点までに得られている製法 c 及び製法 d で製造された原薬 3 ロットの長期保存試験、並
びに製法 C で製造された製剤の長期保存試験において、安定性に大きな問題は認められていないと考え
る。ただし、原薬及び製剤の有効期間の設定に際しては 6 カ月までの安定性を確認する必要があると考
えることから、最終的に設定される有効期間に関しては、実施中の長期保存試験成績を確認した上で報
告(2)に記載する。
2.R.2
ポリソルベート 80 の過量添加により生じたウイルス粒子濃度の定量値の誤りについて
製法 B で製造された一部の製剤において、吸光度法によるウイルス粒子濃度の定量値の誤りが生じて
いたことについて、申請者は以下のように説明した。
海外臨床試験(COV002 試験)に用いられた製剤のウイルス粒子濃度の測定は吸光度法により実施さ
れていたが、製法 B で製造された製剤の一部のロットについて、吸光度法と qPCR 法の両方でウイルス
粒子濃度を測定した結果、吸光度法による測定値は、qPCR 法による測定値に比べて約 2.3 倍高い値を示
した(11.5 項参照)。この原因を解明するため、吸光度法の試験方法を検討した結果、ポリソルベート 80
が吸光度に干渉作用を起こすことにより、ウイルス粒子濃度が実際よりも高い値を示すことが判明した。
また、当該ロットにおけるポリソルベート 80 の含量は、製法 A 及び製法 C の製剤の約 2 倍であること
が示され、その原因は、当該ロットで使用された原薬の薬液調製工程において、誤ってポリソルベート
80 を過量添加していたことであった。当該原因に対応するため、以降の製法 b の原薬及び製法 B の製剤
においては、ポリソルベート 80 の含量の影響を受けない qPCR 法によりウイルス粒子濃度を測定し、臨
床試験用量(5×1010 vp)を決定した。なお、製法 a 及び製法 c の原薬、並びに製法 A 及び製法 C の製剤
9
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
135