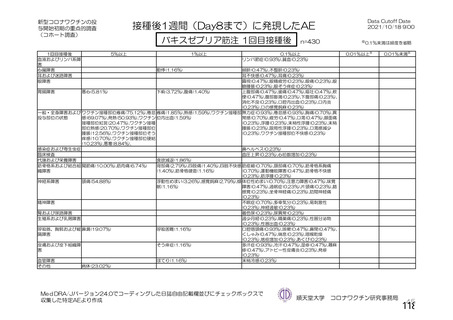
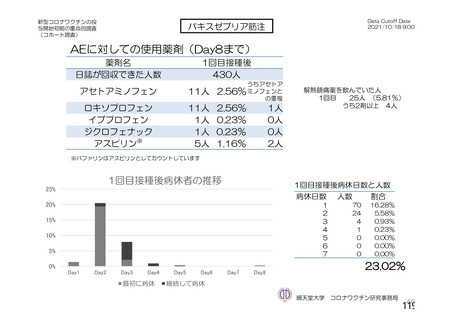
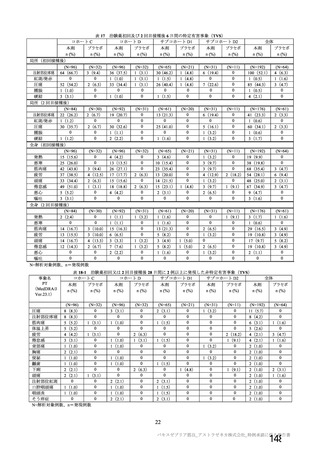
資 料4-2-➀ 令和4年度第2回安全技術調査会の審議結果について➀ (206 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27906.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会(令和4年度第2回 9/14)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
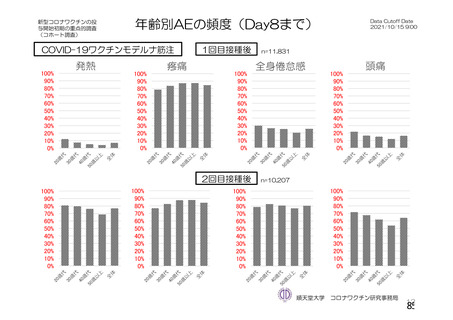
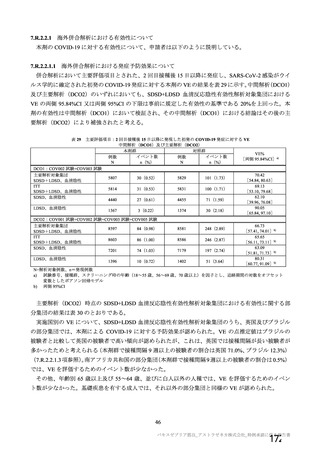
おいて 152 件の有害事象が報告されており、特段の懸念は認められていない。妊婦において 2 件以上報
告された有害事象は表 49 のとおりであった。授乳婦における報告は確認されていない。
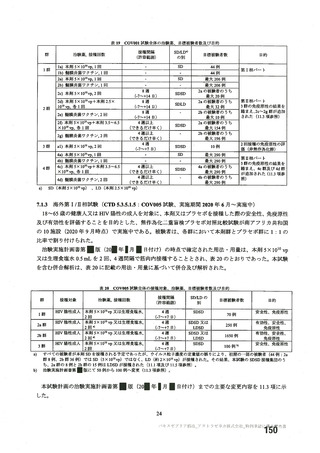
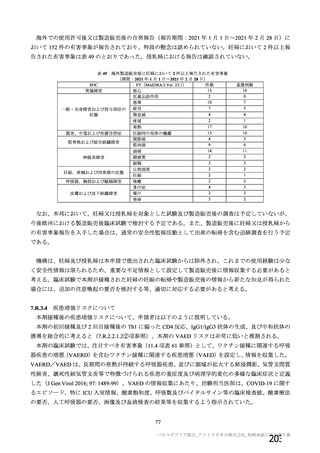
表 49
海外製造販売後に妊婦において 2 件以上報告された有害事象
(期間:2021 年 1 月 1 日~2021 年 2 月 28 日)
SOC
PT(MedDRA/J Ver. 23.1)
件数
13
胃腸障害
悪心
2
医薬品副作用
10
悪寒
7
疲労
一般・全身障害および投与部位の
4
倦怠感
状態
2
疼痛
17
発熱
13
傷害、中毒および処置合併症
妊娠時の母体の曝露
4
関節痛
筋骨格および結合組織障害
9
筋肉痛
14
頭痛
2
錯感覚
神経系障害
3
振戦
2
自然流産
妊娠、産褥および周産期の状態
2
妊娠
2
呼吸器、胸郭および縦隔障害
咳嗽
4
多汗症
2
寝汗
皮膚および皮下組織障害
3
発疹
重篤例数
10
0
7
5
4
1
10
10
3
6
11
2
3
2
1
2
3
2
2
なお、本邦において、妊婦又は授乳婦を対象とした試験及び製造販売後の調査は予定していないが、
今後欧州における製造販売後臨床試験で検討する予定である。また、製造販売後に妊婦又は授乳婦から
の有害事象報告を入手した場合は、通常の安全性監視活動として出産の転帰を含む追跡調査を行う予定
である。
機構は、妊婦及び授乳婦は本申請で提出された臨床試験からは除外され、これまでの使用経験は少な
く安全性情報は限られるため、重要な不足情報として設定して製造販売後に情報収集する必要があると
考える。臨床試験で本剤が接種された妊婦の妊娠の転帰や製造販売後の情報から新たな知見が得られた
場合には、追加の注意喚起の要否を検討する等、適切に対応する必要があると考える。
7.R.3.4
疾患増強リスクについて
本剤接種後の疾患増強リスクについて、申請者は以下のように説明している。
本剤の初回接種及び 2 回目接種後の Th1 に偏った CD4 反応、IgG1/IgG3 抗体の生成、及び中和抗体の
誘導を総合的に考えると(7.R.2.2.1.2②項参照)、本剤の VAED リスクは非常に低いと推測される。
本剤の臨床試験では、注目すべき有害事象(11.4 項表 61 参照)として、ワクチン接種に関連する呼吸
器疾患の増悪(VAERD)を含むワクチン接種に関連する疾患増悪(VAED)を設定し、情報を収集した。
VAERD/VAED は、長期間の発熱が持続する呼吸器疾患、並びに領域が拡大する肺浸潤影、気管支間質
性肺炎、壊死性細気管支炎等で特徴づけられる疾患の重症度及び病理学的変化の多様な臨床症状と定義
した(J Gen Virol 2016; 97: 1489-99)。VAED の情報収集にあたり、治験担当医師は、COVID-19 に関す
るエピソード、特に ICU 入室情報、酸素飽和度、呼吸数及びバイタルサイン等の臨床検査値、酸素療法
の要否、人工呼吸器の要否、画像及び血液検査の結果等を収集するよう指示されていた。
77
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
203