よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
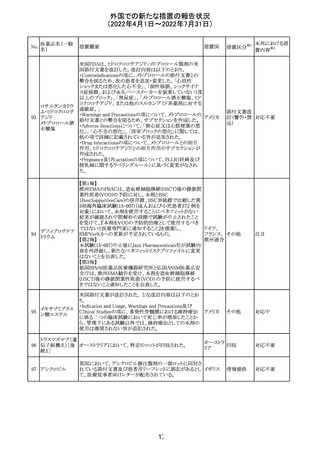
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
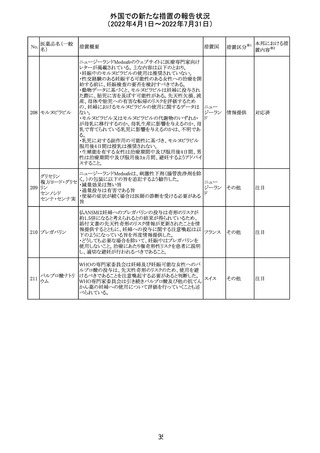
No.
医薬品名(一般
名)
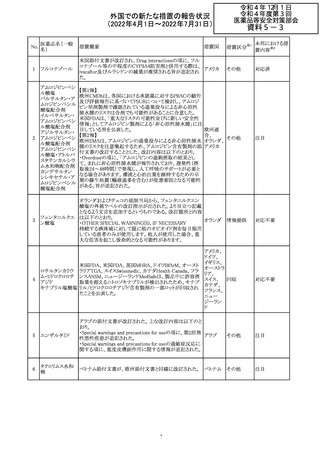
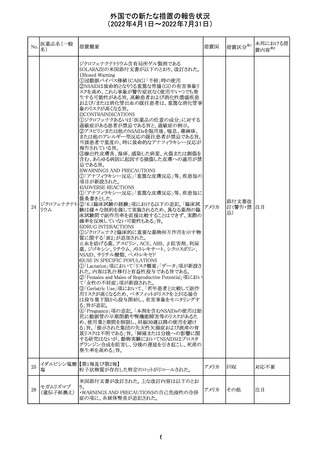
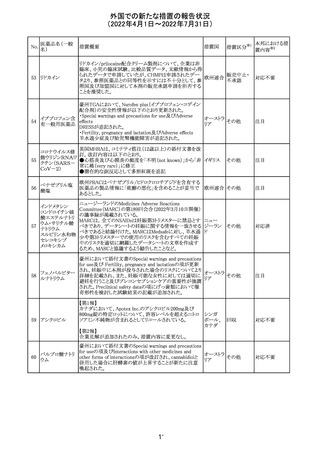
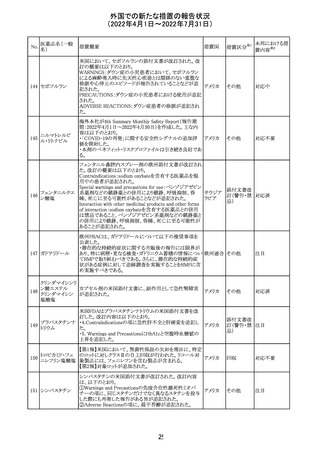
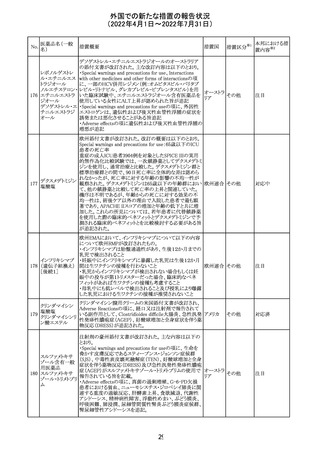
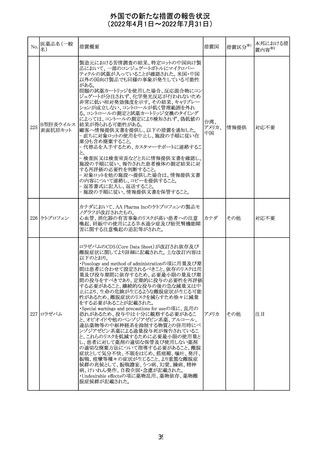
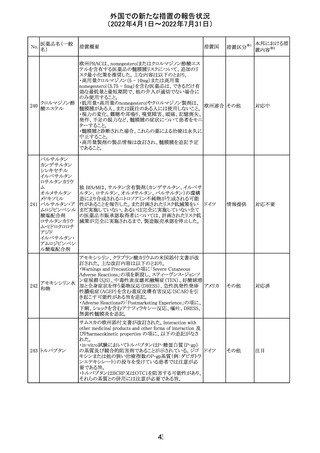
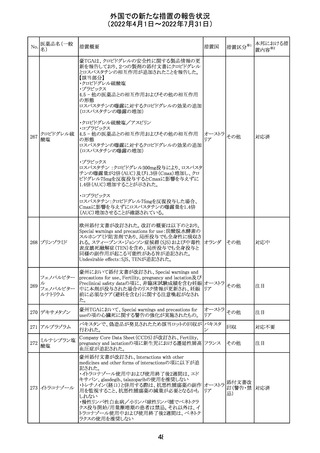
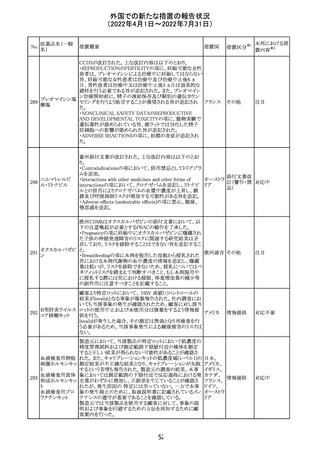
61 クロザピン
62
イリノテカン塩酸
塩水和物
63 プレガバリン
措置概要
措置国
措置区分※1
本邦における措
置内容※2
【第1報及び第2報】
豪州TGAは製造販売後に報告された便秘、腸閉塞等の消
化管運動低下の評価の結果、消化管運動低下について致
死的なリスクになり得ることから添付文書のboxed warnings
において以下の内容を注意喚起する必要があると判断し
た。
・クロザピンの使用により重度の消化管の副作用が発生し、
添付文書改
入院、手術、死亡の転帰に至った症例があること。
オーストラ
訂(警告・禁 対応済
・クロザピンによる治療を開始する前及び治療中に、便秘を リア
忌)
スクリーニングし、必要に応じて、現在の臨床ガイドラインに
従って管理すること。
また、special warnings and precautions for useの項が改訂
され、重度の合併症を伴う消化管運動低下及び抗コリン作
用についての言及がなされ、Adverse effectsの項に、重度
の消化管障害(重度の便秘、腸閉塞、消化管運動低下)が
追加された。
仏国において、UGT1A1活性が低下した患者における開始
用量の減量に関して、医療従事者向けのレターが発出され フランス
た。
情報提供
欧州添付文書において以下の点が改訂されたため、併売
業者は資材の改訂をEMAに通知する必要があるとされた。
・Special warnings and precautionsの項に明確な必要性が
ないときは妊娠期間中はプレガバリンを使用しないこと及び
妊娠可能な女性は効果的な避妊を行うこと記載すること。
・Fertility, pregnancy and lactationの項に妊娠可能な女性 欧州連合 その他
は効果的な避妊を行うこと、プレガバリンはヒト胎盤を通過
する可能性があること及び先天性奇形について記載するこ
と。
・Undesirable effectsの項にパーキンソニズムが追記され
た。
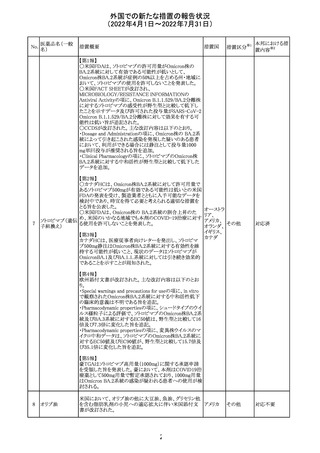
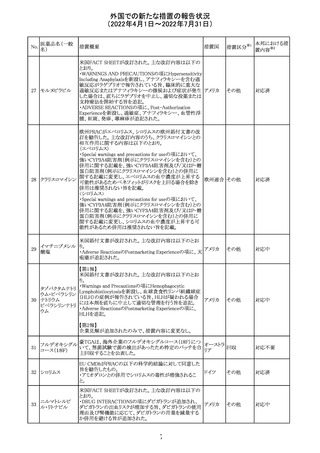
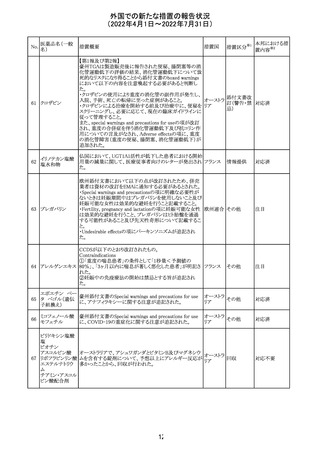
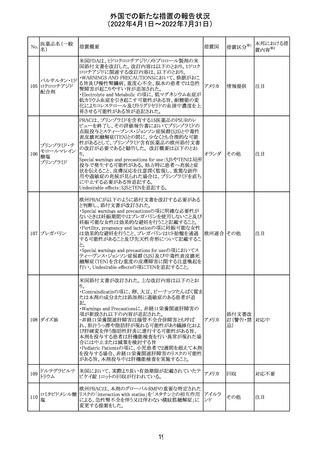
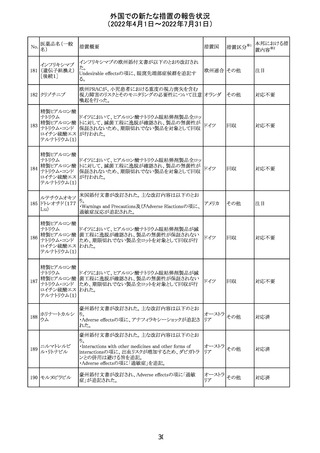
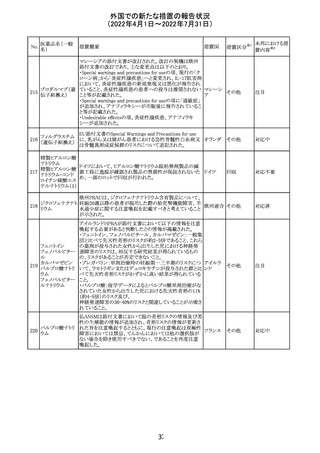
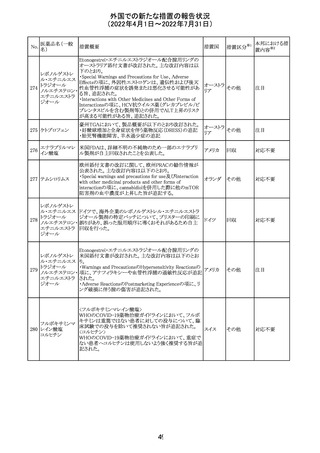
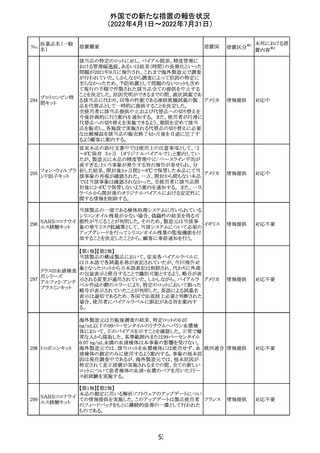
CCDSが以下のとおり改訂されたもの。
Contraindications
①「重度の喘息患者」の条件として「1秒量<予測値の
64 アレルゲンエキス 80%」、「3ヶ月以内に喘息が著しく悪化した患者」が明記さ フランス
れた。
②妊娠中の免疫療法の開始は禁忌とする旨が追記され
た。
その他
対応済
注目
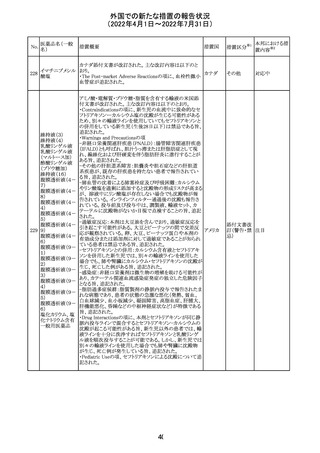
注目
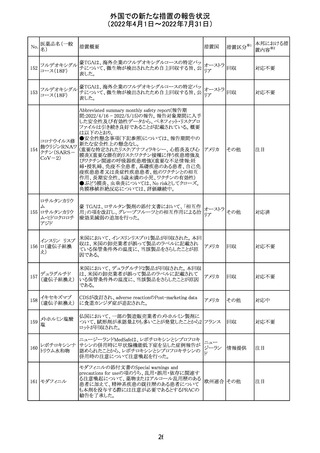
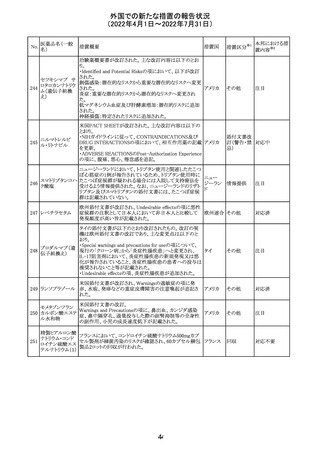
エポエチン ベー
豪州添付文書のSpecial warnings and precautions for use
65 タ ペゴル(遺伝
に、アナフィラキシーに関する注意が追記された。
子組換え)
オーストラ
その他
リア
対応済
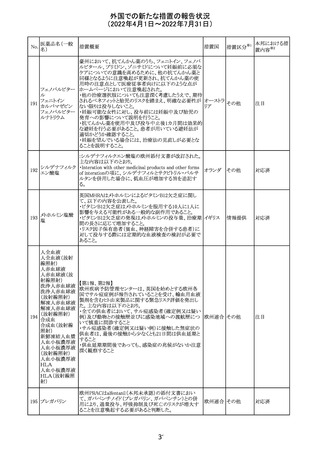
ミコフェノール酸 豪州添付文書のSpecial warnings and precautions for use
モフェチル
に、COVID-19の重症化に関する注意が追記された。
オーストラ
その他
リア
対応済
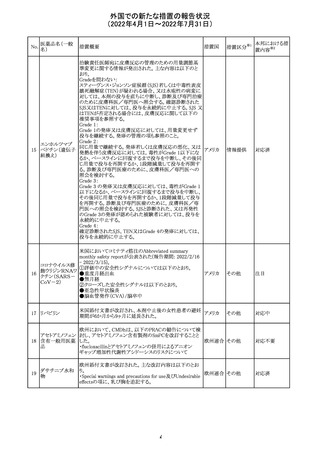
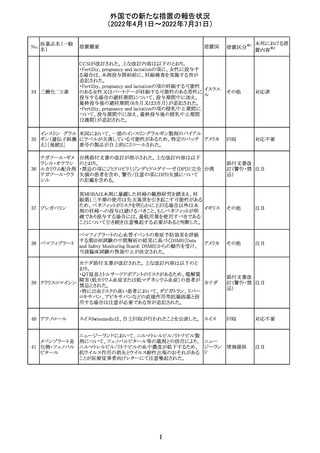
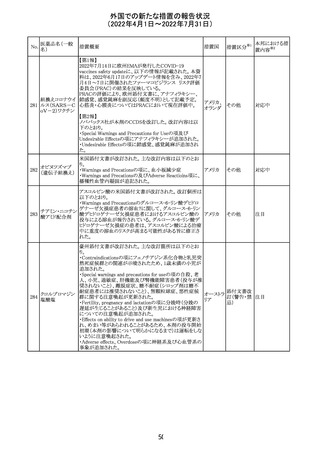
66
ピリドキシン塩酸
塩
ビオチン
アスコルビン酸
オーストラリアで、アシュワガンダとビタミンB及びマグネシウ
オーストラ
67 リボフラビンリン酸 ムを含有する錠剤について、予想以上にアレルギー反応が
回収
リア
エステルナトリウ 多かったことから、回収が行われた。
ム
チアミン・アスコル
ビン酸配合剤
12
対応不要
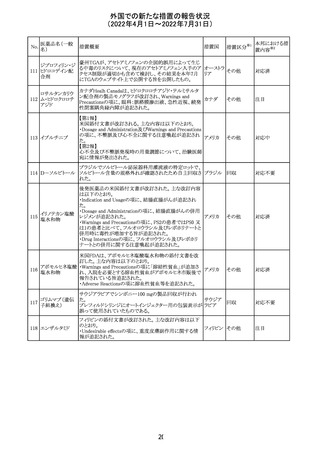
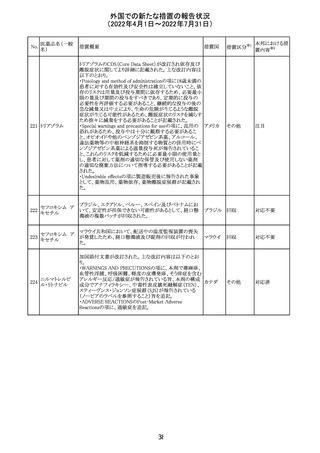
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
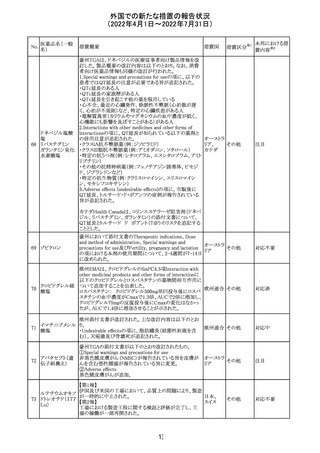
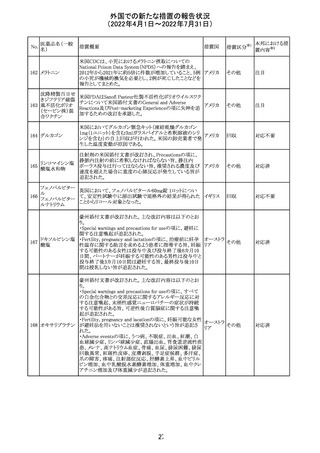
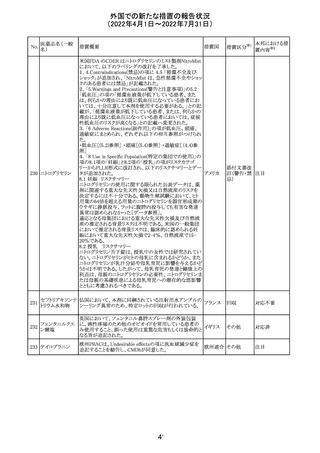
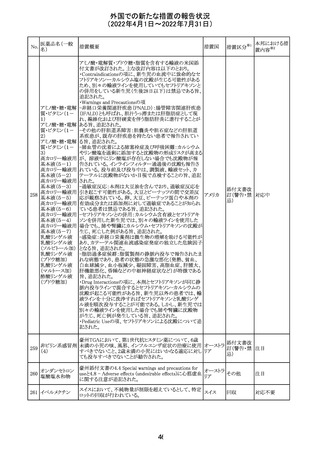
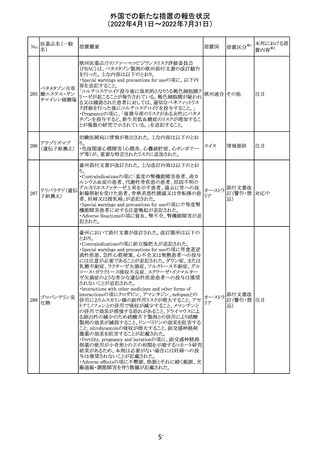
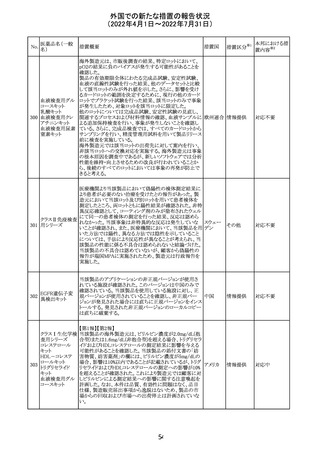
61 クロザピン
62
イリノテカン塩酸
塩水和物
63 プレガバリン
措置概要
措置国
措置区分※1
本邦における措
置内容※2
【第1報及び第2報】
豪州TGAは製造販売後に報告された便秘、腸閉塞等の消
化管運動低下の評価の結果、消化管運動低下について致
死的なリスクになり得ることから添付文書のboxed warnings
において以下の内容を注意喚起する必要があると判断し
た。
・クロザピンの使用により重度の消化管の副作用が発生し、
添付文書改
入院、手術、死亡の転帰に至った症例があること。
オーストラ
訂(警告・禁 対応済
・クロザピンによる治療を開始する前及び治療中に、便秘を リア
忌)
スクリーニングし、必要に応じて、現在の臨床ガイドラインに
従って管理すること。
また、special warnings and precautions for useの項が改訂
され、重度の合併症を伴う消化管運動低下及び抗コリン作
用についての言及がなされ、Adverse effectsの項に、重度
の消化管障害(重度の便秘、腸閉塞、消化管運動低下)が
追加された。
仏国において、UGT1A1活性が低下した患者における開始
用量の減量に関して、医療従事者向けのレターが発出され フランス
た。
情報提供
欧州添付文書において以下の点が改訂されたため、併売
業者は資材の改訂をEMAに通知する必要があるとされた。
・Special warnings and precautionsの項に明確な必要性が
ないときは妊娠期間中はプレガバリンを使用しないこと及び
妊娠可能な女性は効果的な避妊を行うこと記載すること。
・Fertility, pregnancy and lactationの項に妊娠可能な女性 欧州連合 その他
は効果的な避妊を行うこと、プレガバリンはヒト胎盤を通過
する可能性があること及び先天性奇形について記載するこ
と。
・Undesirable effectsの項にパーキンソニズムが追記され
た。
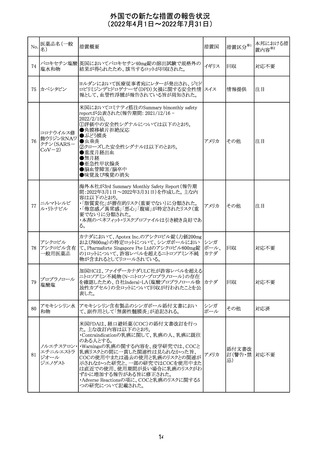
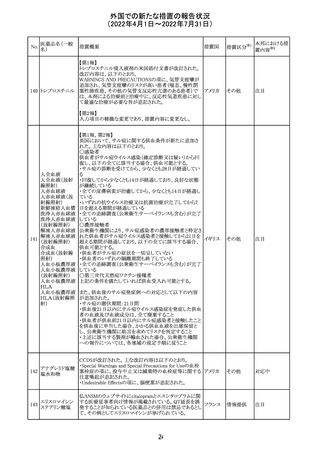
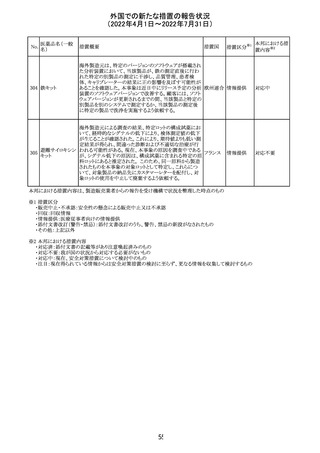
CCDSが以下のとおり改訂されたもの。
Contraindications
①「重度の喘息患者」の条件として「1秒量<予測値の
64 アレルゲンエキス 80%」、「3ヶ月以内に喘息が著しく悪化した患者」が明記さ フランス
れた。
②妊娠中の免疫療法の開始は禁忌とする旨が追記され
た。
その他
対応済
注目
注目
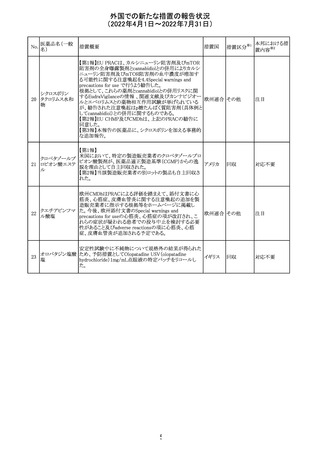
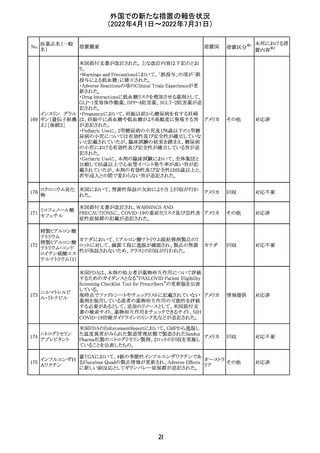
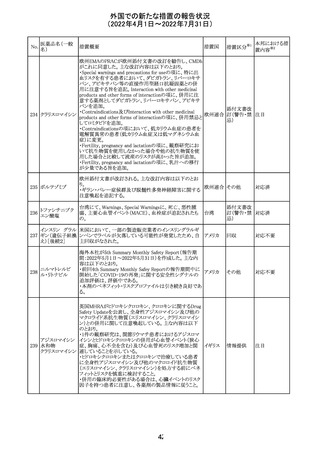
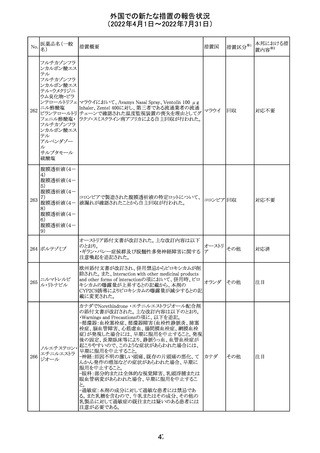
エポエチン ベー
豪州添付文書のSpecial warnings and precautions for use
65 タ ペゴル(遺伝
に、アナフィラキシーに関する注意が追記された。
子組換え)
オーストラ
その他
リア
対応済
ミコフェノール酸 豪州添付文書のSpecial warnings and precautions for use
モフェチル
に、COVID-19の重症化に関する注意が追記された。
オーストラ
その他
リア
対応済
66
ピリドキシン塩酸
塩
ビオチン
アスコルビン酸
オーストラリアで、アシュワガンダとビタミンB及びマグネシウ
オーストラ
67 リボフラビンリン酸 ムを含有する錠剤について、予想以上にアレルギー反応が
回収
リア
エステルナトリウ 多かったことから、回収が行われた。
ム
チアミン・アスコル
ビン酸配合剤
12
対応不要