よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
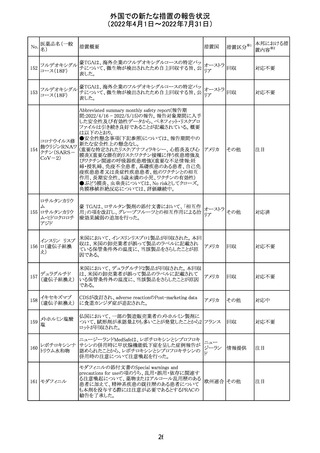
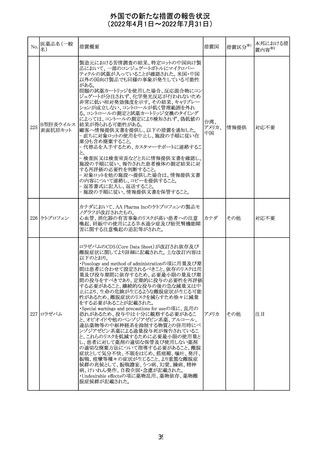
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
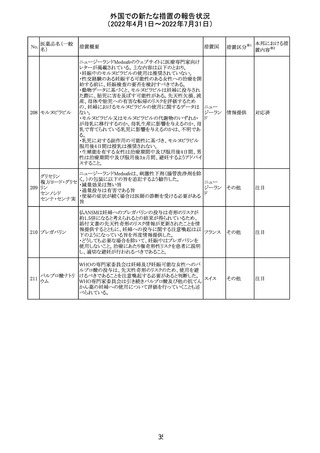
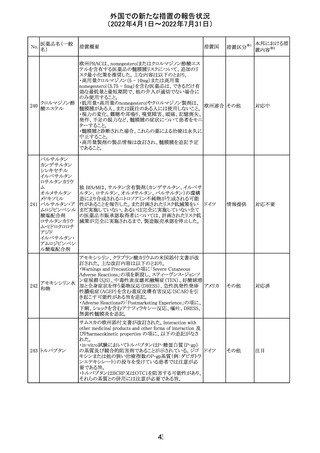
No.
医薬品名(一般
名)
措置概要
措置国
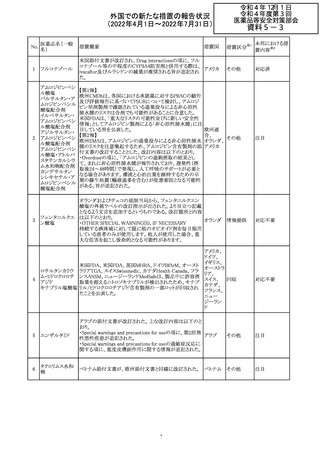
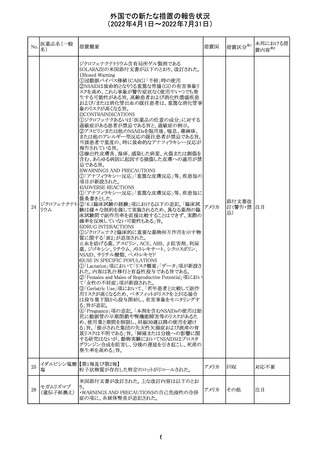
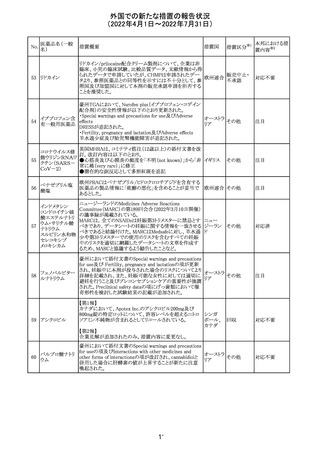
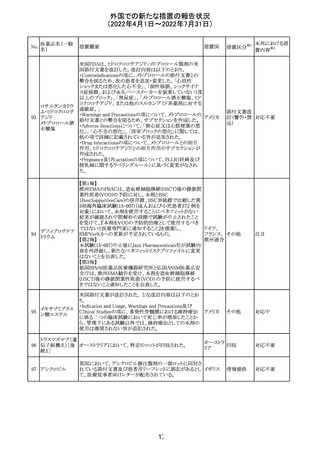
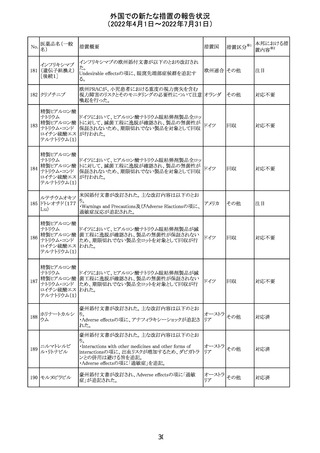
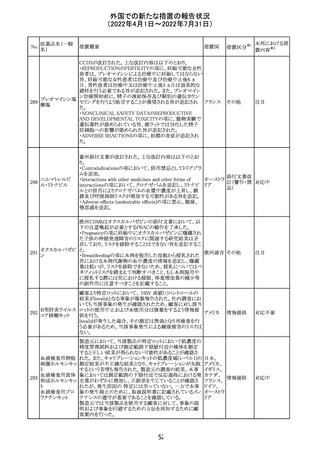
ジクロフェナクナトリウム含有局所ゲル製剤である
SOLARAZEの米国添付文書が以下のとおり、改訂された。
1)Boxed Warning
①冠動脈バイパス移植(CABG)「手術」時の使用
②NSAIDは致命的となりうる重篤な胃腸(GI)の有害事象リ
スクを高め、これら事象が警告症状なく使用中いつでも発
生する可能性がある旨。高齢患者および消化性潰瘍疾患
および/または消化管出血の既往患者は、重篤な消化管事
象のリスクが高くなる旨。
2)CONTRAINDICATIONS
①ジクロフェナクあるいは「医薬品の任意の成分」に対する
過敏症がある患者が禁忌である旨と、過敏症の例示。
②アスピリンまたは他のNSAIDsを服用後、喘息、蕁麻疹、
または他のアレルギー型反応の既往患者が禁忌である旨。
当該患者で重度の、時に致命的なアナフィラキシー反応が
報告されている旨。
③滲出性皮膚炎、湿疹、感染した病変、火傷または創傷を
含む、あらゆる病因に起因する損傷した皮膚への適用が禁
忌である旨。
3)WARNINGS AND PRECAUTIONS
①「アナフィラキシー反応」「重篤な皮膚反応」等、疾患毎の
項目が新設された。
4)ADVERSE REACTIONS
①「アナフィラキシー反応」「重篤な皮膚反応」等、疾患毎に
箇条書きとした。
ジクロフェナクナト ②「6.1臨床試験の経験」項における以下の追記。「臨床試
24
アメリカ
リウム
験は様々な制約を課して実施されるため、異なる薬剤の臨
床試験間で副作用率を直接比較することはできず、実際の
確率を反映していない可能性もある」旨。
5)DRUG INTERACTIONS
①ジクロフェナクと臨床的に重要な薬物相互作用を示す物
質に関する「表2」が追加された。
止血を妨げる薬、アスピリン、ACE、ARB、β阻害剤、利尿
薬、ジゴキシン、リチウム、メトトレキサート、シクロスポリン、
NSAID、サリチル酸類、ペメトレキセド
6)USE IN SPECIFIC POPULATIONS
①「Lactation」項において「リスク概要」「データ」項が新設さ
れた。内容は乳汁移行と有益性投与である旨である。
②「Females and Males of Reproductive Potential」項におい
て「女性の不妊症」項が新設された。
③「Geriatric Use」項において、「若年患者と比較して副作
用リスクが高くなるため、ベネフィットがリスクを上回る場合
は投与量下限から投与開始し、有害事象をモニタリングす
る」旨が追記。
④「Pregnancy」項の追記。「本剤を含むNSAIDsの使用は胎
児に動脈管の早期閉鎖や腎機能障害等のリスクがあるた
め、使用量と期間を制限し、妊娠30週以降の使用を避け
る」旨。「提示された集団の先天性欠損症および流産の背
景リスクは不明である」旨。「陣痛または分娩への影響に関
する研究はないが、動物実験においてNSAIDSはプロスタ
グランジン合成を阻害し、分娩の遅延を引き起こし、死産の
発生率を高める」旨。
措置区分※1
本邦における措
置内容※2
添付文書改
訂(警告・禁 注目
忌)
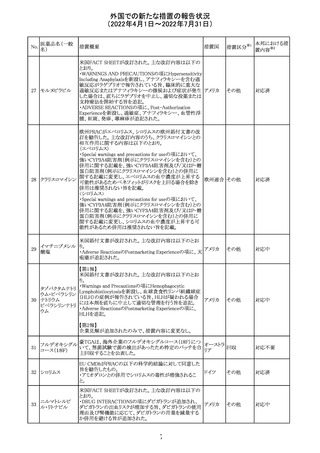
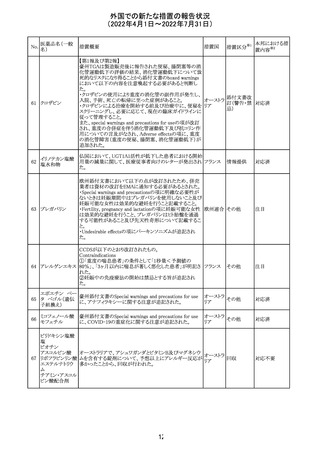
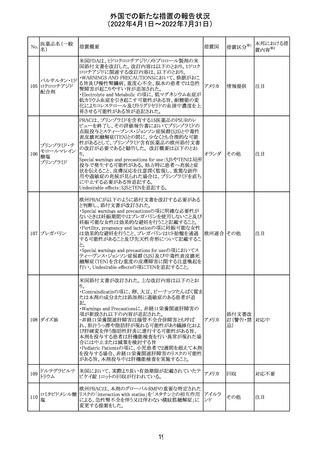
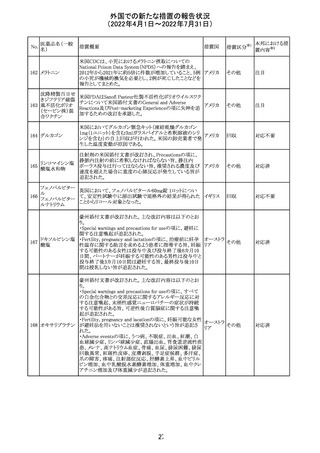
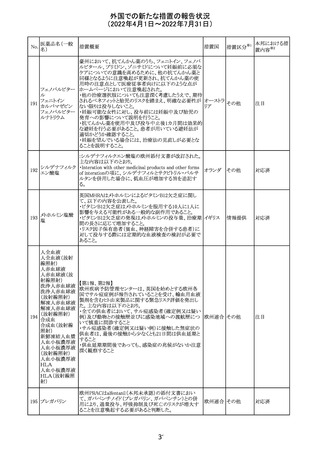
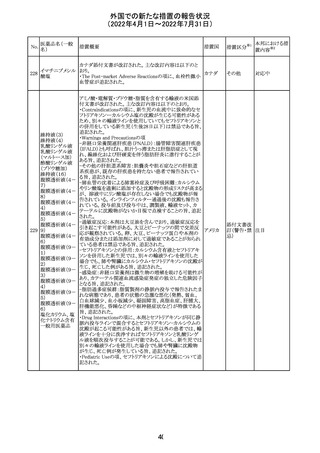
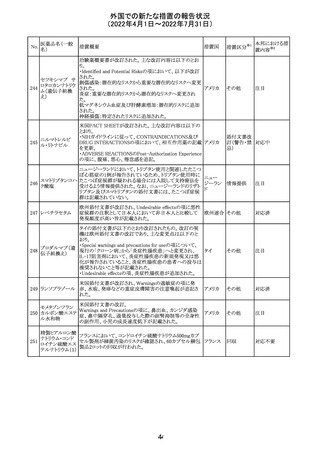
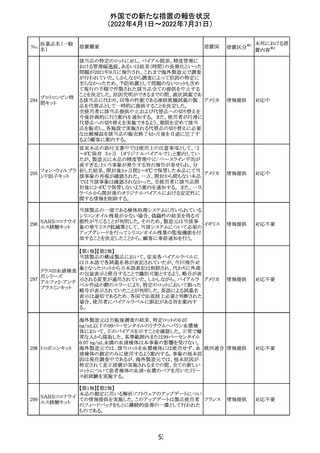
イダルビシン塩酸 【第1報及び第2報】
塩
粒子状物質が存在した特定のロットがリコールされた。
アメリカ
回収
対応不要
米国添付文書が改訂された。主な改訂内容は以下のとお
モガムリズマブ
り。
26
(遺伝子組換え) ・WARNINGS AND PRECAUTIONSの自己免疫性の合併
症の項に、糸球体腎炎が追記された。
アメリカ
その他
注目
25
6
(2022年4月1日~2022年7月31日)
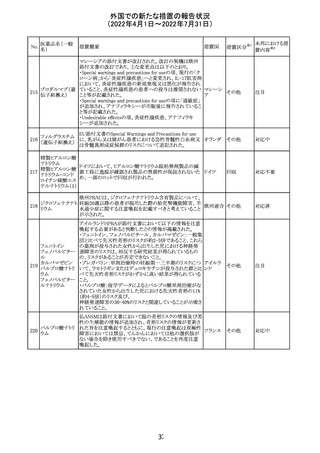
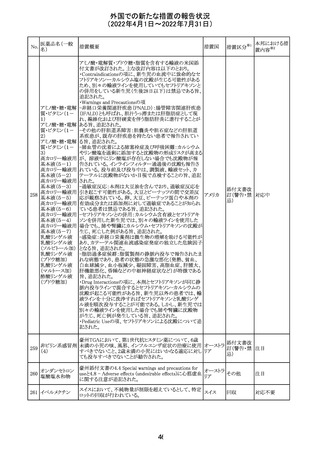
No.
医薬品名(一般
名)
措置概要
措置国
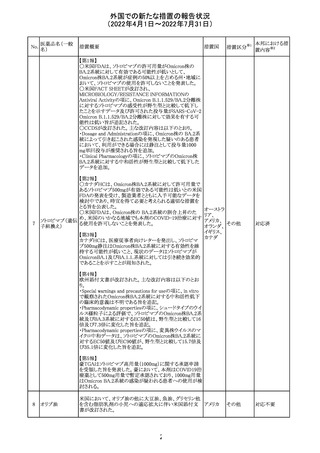
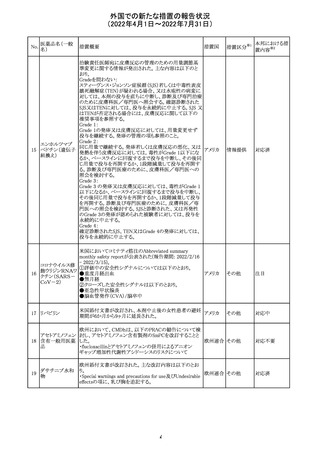
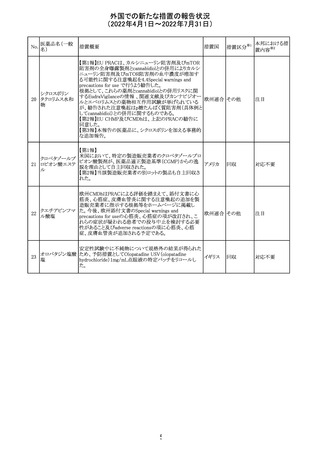
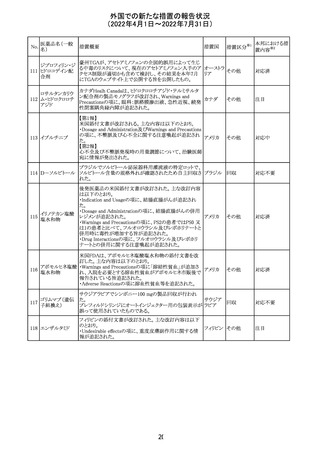
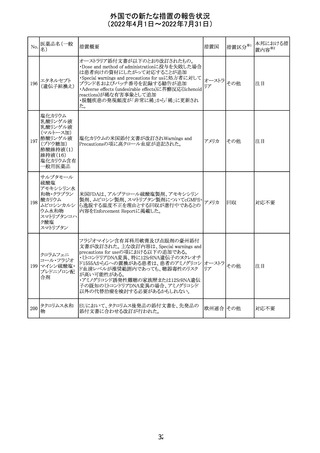
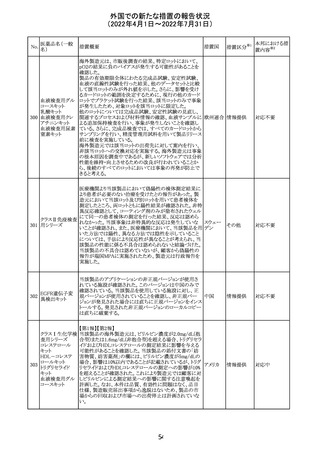
ジクロフェナクナトリウム含有局所ゲル製剤である
SOLARAZEの米国添付文書が以下のとおり、改訂された。
1)Boxed Warning
①冠動脈バイパス移植(CABG)「手術」時の使用
②NSAIDは致命的となりうる重篤な胃腸(GI)の有害事象リ
スクを高め、これら事象が警告症状なく使用中いつでも発
生する可能性がある旨。高齢患者および消化性潰瘍疾患
および/または消化管出血の既往患者は、重篤な消化管事
象のリスクが高くなる旨。
2)CONTRAINDICATIONS
①ジクロフェナクあるいは「医薬品の任意の成分」に対する
過敏症がある患者が禁忌である旨と、過敏症の例示。
②アスピリンまたは他のNSAIDsを服用後、喘息、蕁麻疹、
または他のアレルギー型反応の既往患者が禁忌である旨。
当該患者で重度の、時に致命的なアナフィラキシー反応が
報告されている旨。
③滲出性皮膚炎、湿疹、感染した病変、火傷または創傷を
含む、あらゆる病因に起因する損傷した皮膚への適用が禁
忌である旨。
3)WARNINGS AND PRECAUTIONS
①「アナフィラキシー反応」「重篤な皮膚反応」等、疾患毎の
項目が新設された。
4)ADVERSE REACTIONS
①「アナフィラキシー反応」「重篤な皮膚反応」等、疾患毎に
箇条書きとした。
ジクロフェナクナト ②「6.1臨床試験の経験」項における以下の追記。「臨床試
24
アメリカ
リウム
験は様々な制約を課して実施されるため、異なる薬剤の臨
床試験間で副作用率を直接比較することはできず、実際の
確率を反映していない可能性もある」旨。
5)DRUG INTERACTIONS
①ジクロフェナクと臨床的に重要な薬物相互作用を示す物
質に関する「表2」が追加された。
止血を妨げる薬、アスピリン、ACE、ARB、β阻害剤、利尿
薬、ジゴキシン、リチウム、メトトレキサート、シクロスポリン、
NSAID、サリチル酸類、ペメトレキセド
6)USE IN SPECIFIC POPULATIONS
①「Lactation」項において「リスク概要」「データ」項が新設さ
れた。内容は乳汁移行と有益性投与である旨である。
②「Females and Males of Reproductive Potential」項におい
て「女性の不妊症」項が新設された。
③「Geriatric Use」項において、「若年患者と比較して副作
用リスクが高くなるため、ベネフィットがリスクを上回る場合
は投与量下限から投与開始し、有害事象をモニタリングす
る」旨が追記。
④「Pregnancy」項の追記。「本剤を含むNSAIDsの使用は胎
児に動脈管の早期閉鎖や腎機能障害等のリスクがあるた
め、使用量と期間を制限し、妊娠30週以降の使用を避け
る」旨。「提示された集団の先天性欠損症および流産の背
景リスクは不明である」旨。「陣痛または分娩への影響に関
する研究はないが、動物実験においてNSAIDSはプロスタ
グランジン合成を阻害し、分娩の遅延を引き起こし、死産の
発生率を高める」旨。
措置区分※1
本邦における措
置内容※2
添付文書改
訂(警告・禁 注目
忌)
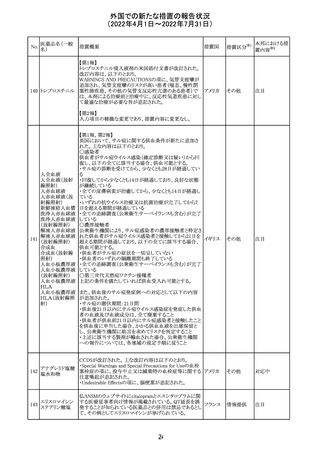
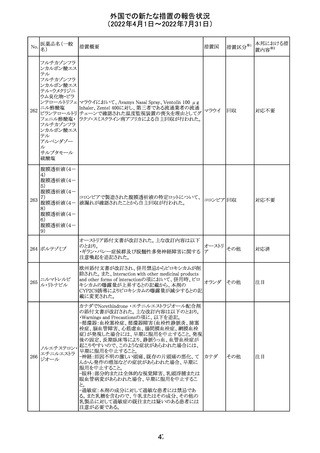
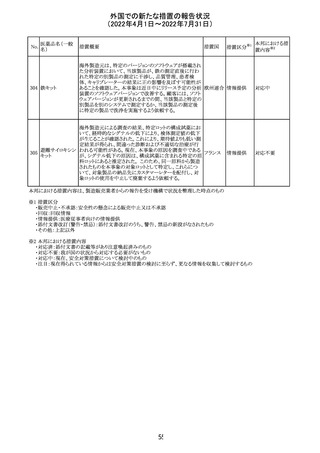
イダルビシン塩酸 【第1報及び第2報】
塩
粒子状物質が存在した特定のロットがリコールされた。
アメリカ
回収
対応不要
米国添付文書が改訂された。主な改訂内容は以下のとお
モガムリズマブ
り。
26
(遺伝子組換え) ・WARNINGS AND PRECAUTIONSの自己免疫性の合併
症の項に、糸球体腎炎が追記された。
アメリカ
その他
注目
25
6