よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
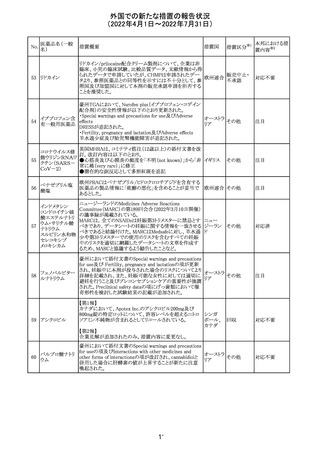
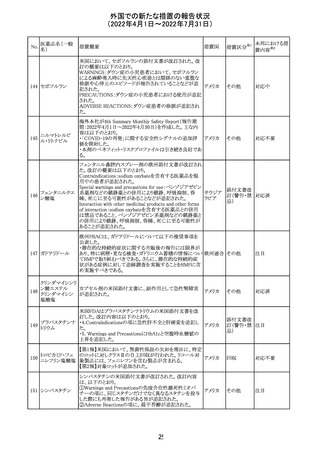
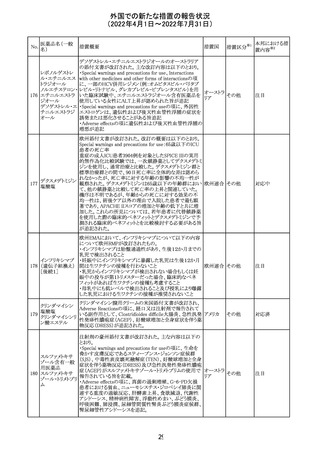
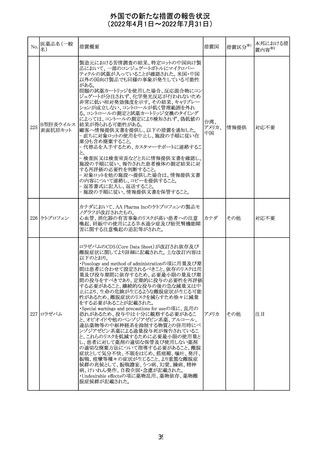
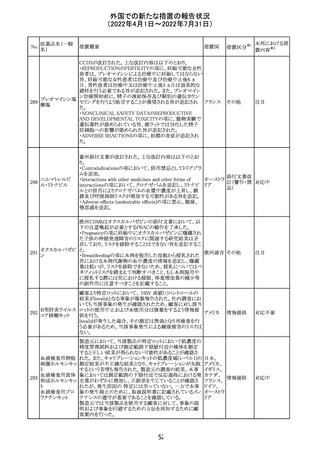
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
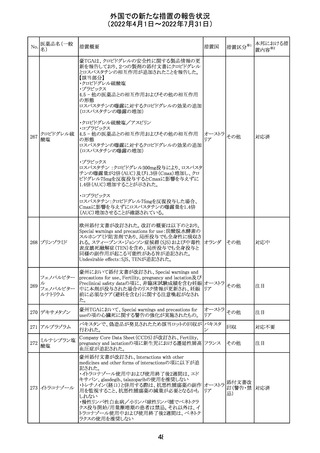
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
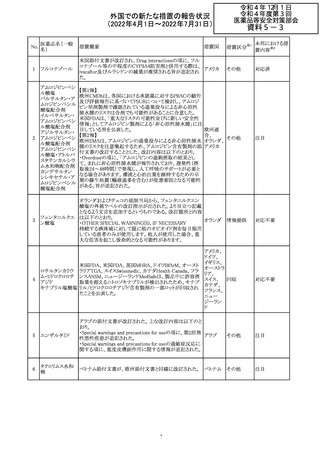
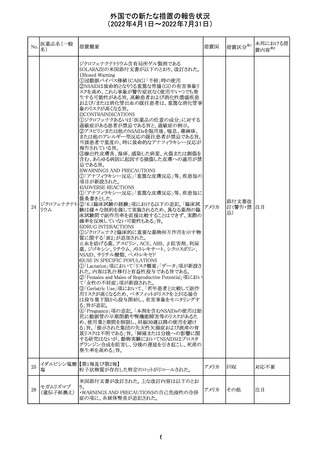
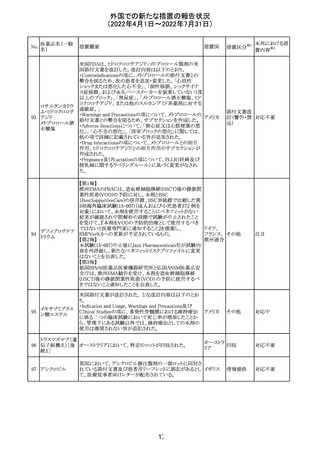
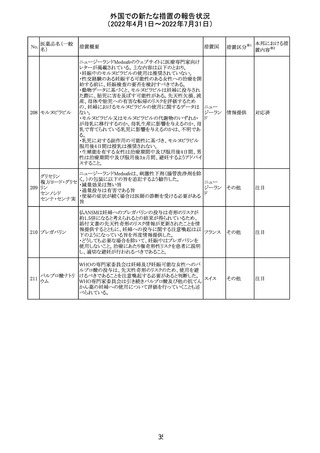
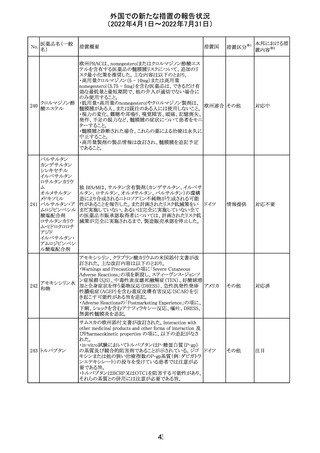
マレーシアの添付文書が改訂された。改訂の契機は欧州
添付文書の改訂であり、主な変更点は以下のとおり。
・Special warnings and precautions for useの項、現行の「ク
ローン病」から「炎症性腸疾患」へと変更され、IL-17阻害剤
において、炎症性腸疾患の新規発現又は悪化が報告され
ブロダルマブ(遺 ていること、炎症性腸疾患の患者への投与は推奨されない マレーシ
215
その他
伝子組換え)
こと等が記載された。
ア
・Special warnings and precautions for useの項に「過敏症」
が追加され、アナフィラキシーが市販後に報告されているこ
と等が記載された。
・Undesirable effectsの項、炎症性腸疾患、アナフィラキ
シーが追加された。
216
EU添付文書のSpecial Warnings and Precautions for use
フィルグラスチム
に、乳がん又は肺がん患者における急性骨髄性白血病又 オランダ
(遺伝子組換え)
は骨髄異形成症候群のリスクについて追記された。
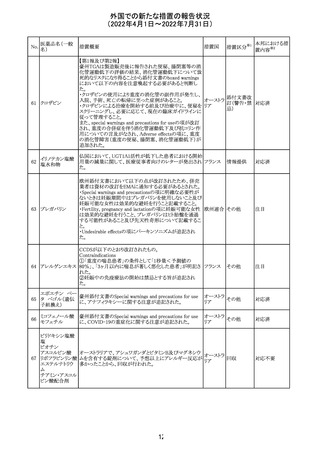
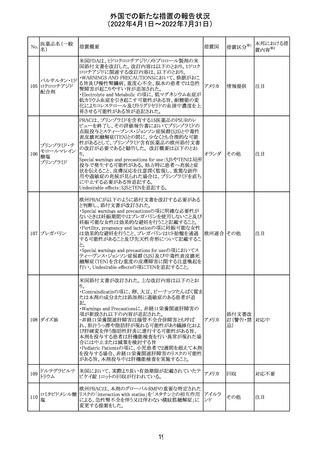
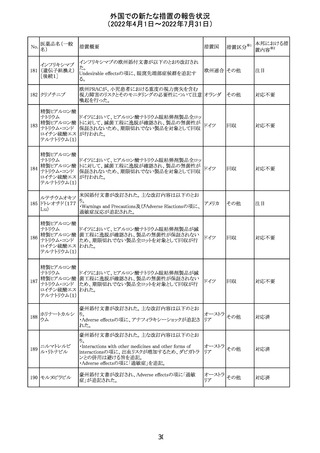
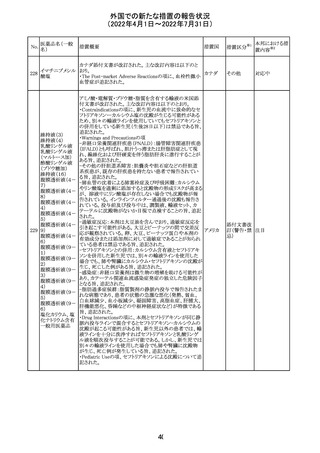
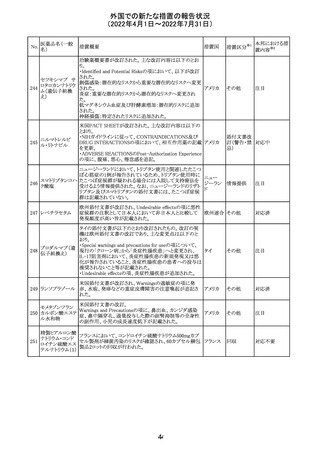
精製ヒアルロン酸
ナトリウム
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅
精製ヒアルロン酸
217
菌工程に逸脱が確認され製品の無菌性が保証されないた ドイツ
ナトリウム・コンド
め、一部のロットで回収が行われた。
ロイチン硫酸エス
テルナトリウム(1)
本邦における措
置内容※2
注目
その他
対応中
回収
対応不要
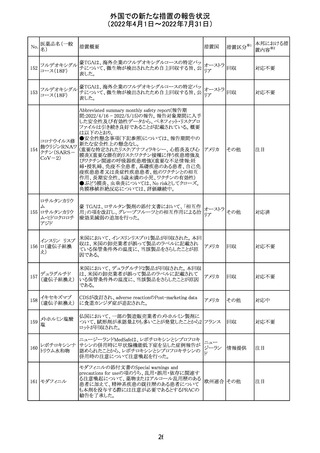
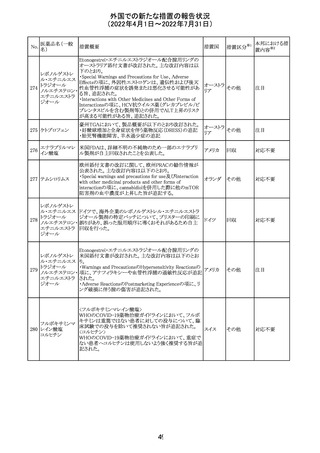
欧州PRACは、ジクロフェナクナトリウム含有製品について、
ジクロフェナクナト 妊娠20週以降の患者が服用した際の胎児腎機能障害、羊
218
欧州連合 その他
リウム
水過少症に関する注意喚起を記載すべきと考えていること
が示された。
対応済
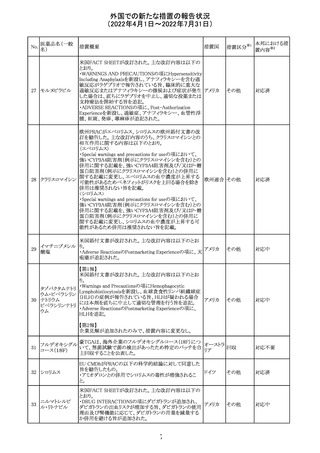
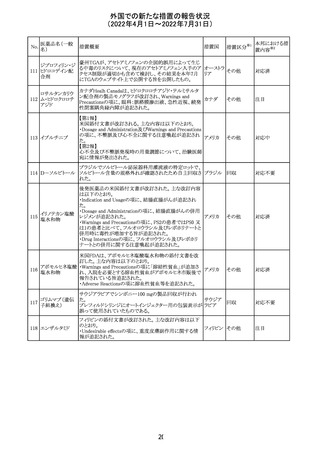
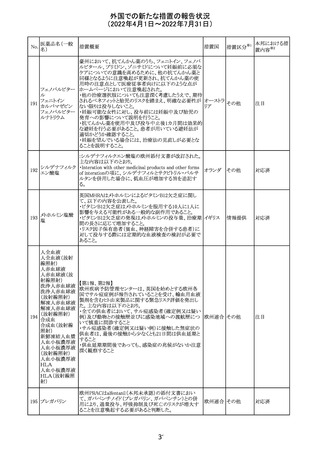
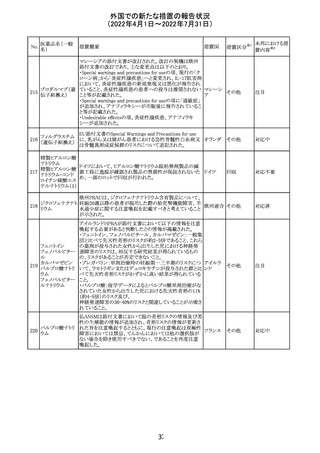
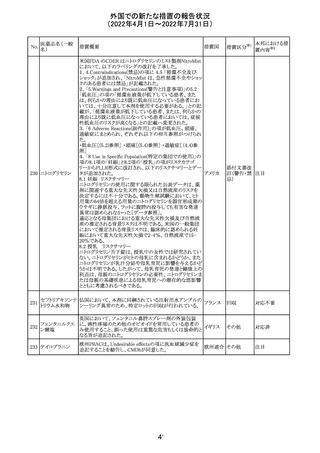
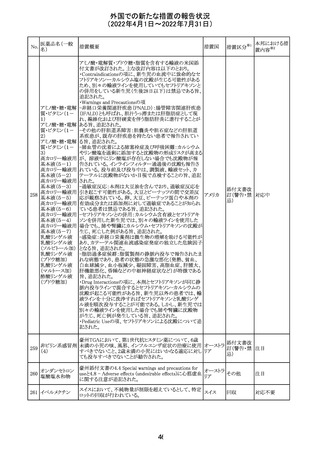
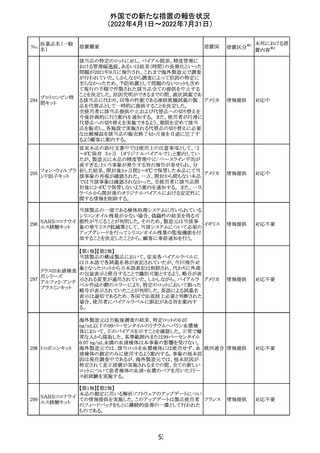
アイルランドHPRAが添付文書において以下の情報を注意
喚起する必要があると判断したとの情報が掲載された。
・フェニトイン、フェノバルビタール、カルバマゼピン:一般集
団と比べて先天性奇形のリスクが約2-3倍であること、これら
フェニトイン
の薬剤が投与された女性から出生した児における神経発
フェノバルビター 達障害のリスクは、相反する研究結果が得られているもの
ル
の、リスクがあることが否定できないこと。
カルバマゼピン ・プレガバリン:単剤治療時の妊娠第一三半期のリスクにつ アイルラ
219
バルプロ酸ナトリ いて、ラモトリギンまたはデュロキセチンが投与された群と比 ンド
ウム
べて先天性奇形リスクがわずかに高い結果が得られている
フェノバルビター こと。
ルナトリウム
・バルプロ酸:疫学データによるとバルプロ酸単剤治療がな
されていた女性から出生した児における先天性奇形の11%
(約4-5倍)のリスク及び、
神経発達障害の30-40%のリスクと関連していることが示唆さ
れていること。
その他
注目
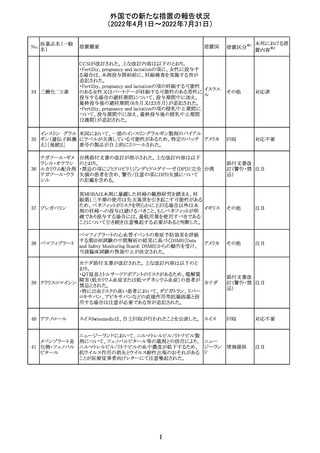
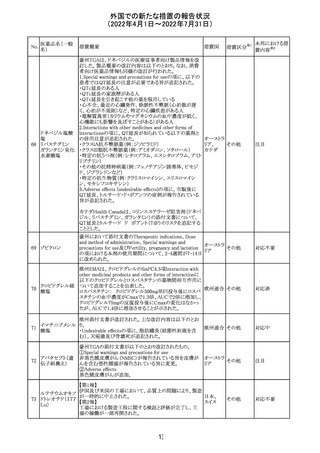
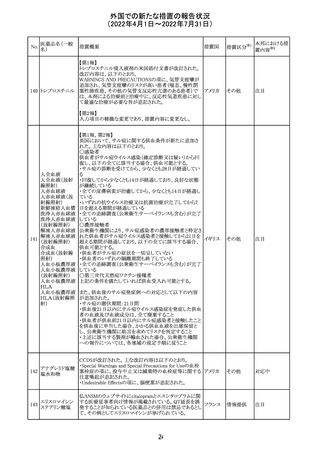
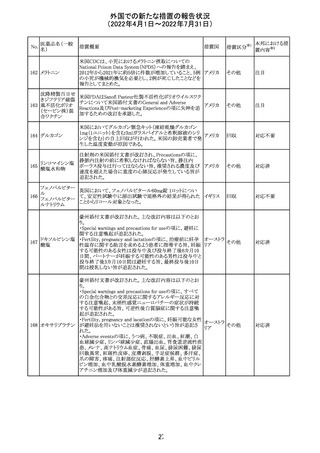
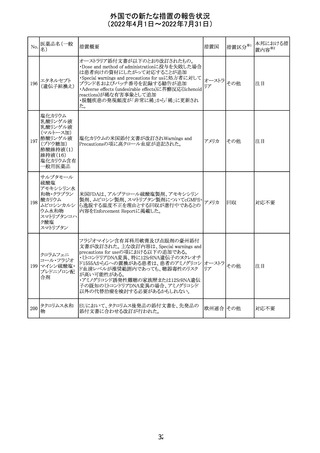
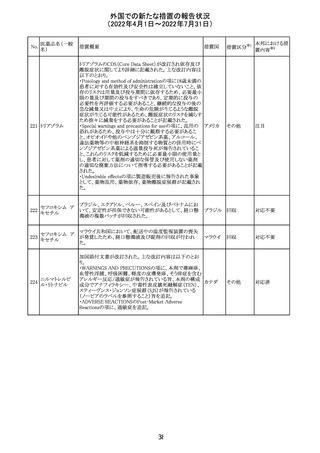
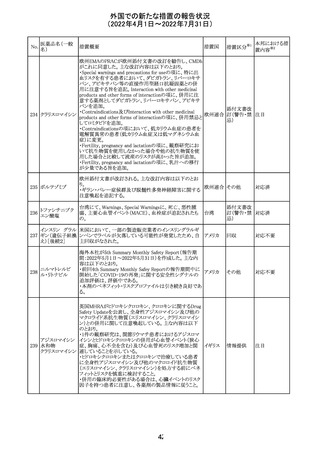
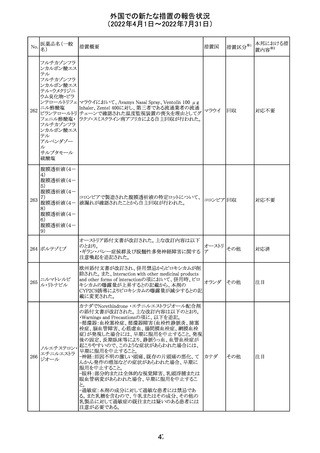
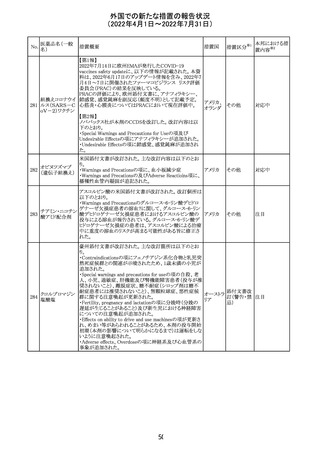
仏ANSMは添付文書において眼の奇形リスクの情報及び男
性の生殖能の情報が追加され、奇形リスクの情報が更新さ
バルプロ酸ナトリ れた旨を注意喚起するとともに、現行の注意喚起は双極性
220
フランス
ウム
障害においては禁忌、てんかんにおいては他の選択肢が
ない場合を除き使用すべきでない、であることを再度注意
喚起した。
その他
対応中
37
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
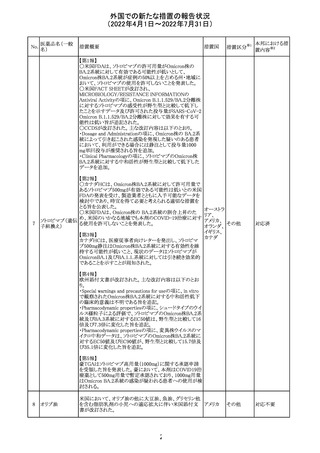
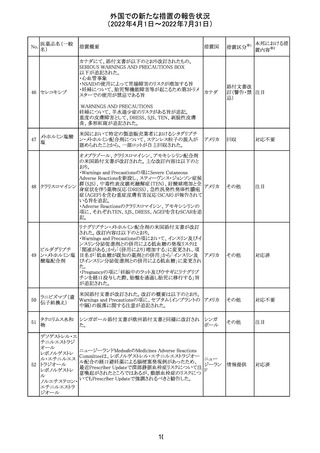
マレーシアの添付文書が改訂された。改訂の契機は欧州
添付文書の改訂であり、主な変更点は以下のとおり。
・Special warnings and precautions for useの項、現行の「ク
ローン病」から「炎症性腸疾患」へと変更され、IL-17阻害剤
において、炎症性腸疾患の新規発現又は悪化が報告され
ブロダルマブ(遺 ていること、炎症性腸疾患の患者への投与は推奨されない マレーシ
215
その他
伝子組換え)
こと等が記載された。
ア
・Special warnings and precautions for useの項に「過敏症」
が追加され、アナフィラキシーが市販後に報告されているこ
と等が記載された。
・Undesirable effectsの項、炎症性腸疾患、アナフィラキ
シーが追加された。
216
EU添付文書のSpecial Warnings and Precautions for use
フィルグラスチム
に、乳がん又は肺がん患者における急性骨髄性白血病又 オランダ
(遺伝子組換え)
は骨髄異形成症候群のリスクについて追記された。
精製ヒアルロン酸
ナトリウム
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅
精製ヒアルロン酸
217
菌工程に逸脱が確認され製品の無菌性が保証されないた ドイツ
ナトリウム・コンド
め、一部のロットで回収が行われた。
ロイチン硫酸エス
テルナトリウム(1)
本邦における措
置内容※2
注目
その他
対応中
回収
対応不要
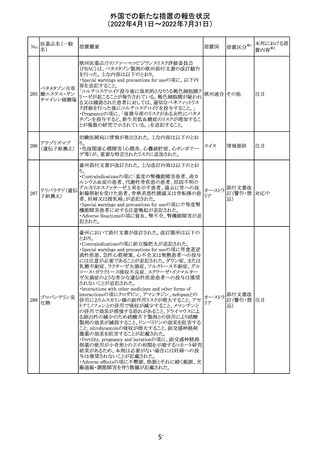
欧州PRACは、ジクロフェナクナトリウム含有製品について、
ジクロフェナクナト 妊娠20週以降の患者が服用した際の胎児腎機能障害、羊
218
欧州連合 その他
リウム
水過少症に関する注意喚起を記載すべきと考えていること
が示された。
対応済
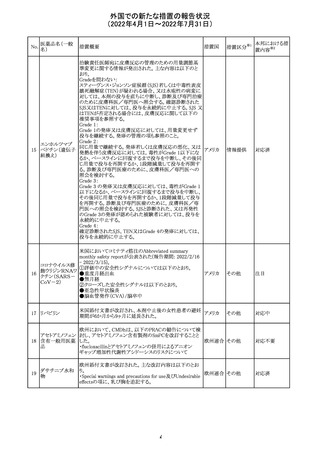
アイルランドHPRAが添付文書において以下の情報を注意
喚起する必要があると判断したとの情報が掲載された。
・フェニトイン、フェノバルビタール、カルバマゼピン:一般集
団と比べて先天性奇形のリスクが約2-3倍であること、これら
フェニトイン
の薬剤が投与された女性から出生した児における神経発
フェノバルビター 達障害のリスクは、相反する研究結果が得られているもの
ル
の、リスクがあることが否定できないこと。
カルバマゼピン ・プレガバリン:単剤治療時の妊娠第一三半期のリスクにつ アイルラ
219
バルプロ酸ナトリ いて、ラモトリギンまたはデュロキセチンが投与された群と比 ンド
ウム
べて先天性奇形リスクがわずかに高い結果が得られている
フェノバルビター こと。
ルナトリウム
・バルプロ酸:疫学データによるとバルプロ酸単剤治療がな
されていた女性から出生した児における先天性奇形の11%
(約4-5倍)のリスク及び、
神経発達障害の30-40%のリスクと関連していることが示唆さ
れていること。
その他
注目
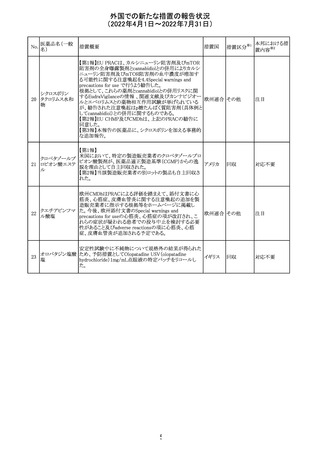
仏ANSMは添付文書において眼の奇形リスクの情報及び男
性の生殖能の情報が追加され、奇形リスクの情報が更新さ
バルプロ酸ナトリ れた旨を注意喚起するとともに、現行の注意喚起は双極性
220
フランス
ウム
障害においては禁忌、てんかんにおいては他の選択肢が
ない場合を除き使用すべきでない、であることを再度注意
喚起した。
その他
対応中
37