よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
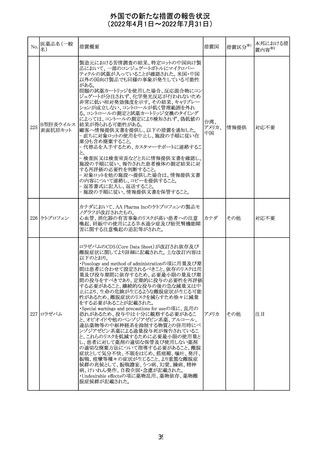
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
措置区分※1
本邦における措
置内容※2
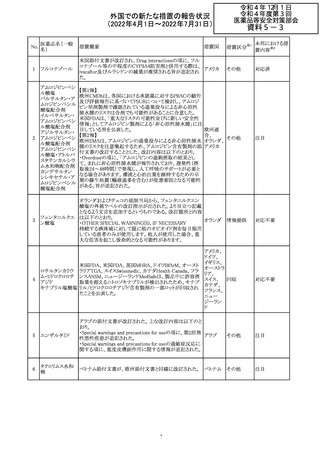
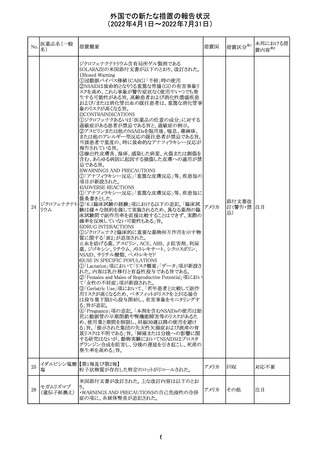
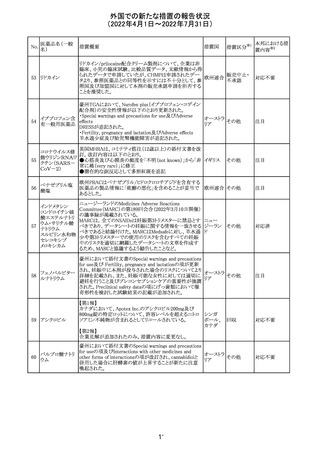
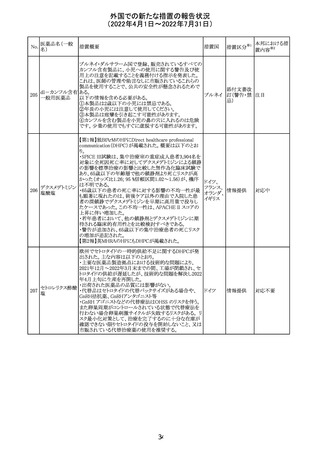
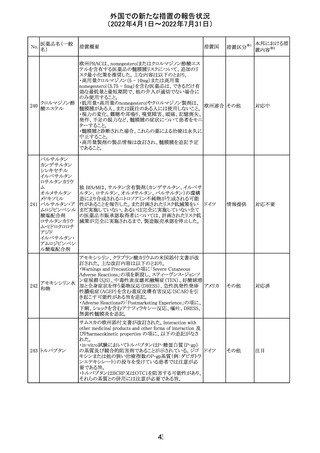
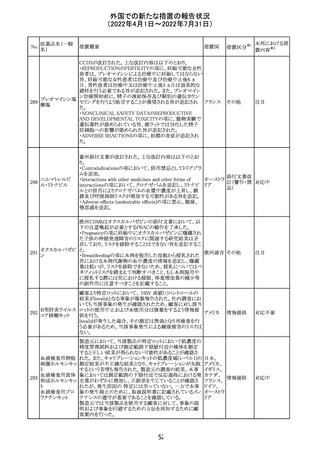
CCDSが改訂されたもの。
①Wanings and Precautionsに「子宮内曝露」の項目が追加
され、以下が追記された。
・子宮内で本剤に曝露した乳児は、生ワクチン接種前に6
か月間の期間を空けることが推奨されること。
・乳児からウステキヌマブが検出されない場合もしくは妊娠
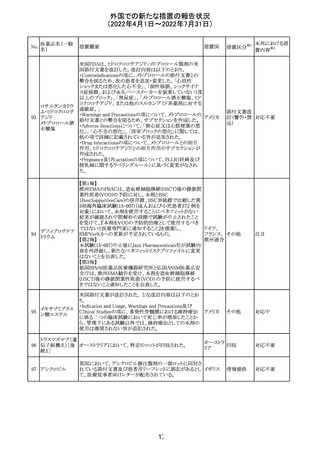
ウステキヌマブ
中の投与が妊娠初期だった場合、臨床的なベネフィットが
89
アメリカ
(遺伝子組換え) あれば生ワクチンの接種も考慮すること
②Interactionの項に、生ワクチンと本剤を併用すべきでな
い旨が追記された。
③Pregnancy, Breast-feeding and Fertilityの項に、公表文
献より、きわめて少量のウステキヌマブが母乳に移行するこ
と、ウステキヌマブは消化管で分解されるため、授乳による
乳児での全身曝露は少量であると予想されること。
その他
注目
90 アパルタミド
CCDSが改訂される。主な改訂内容は以下のとおり。
・Warning and Precautionsの項に、好酸球増加と全身症状 アメリカ
を伴う薬疹が追記される。
その他
注目
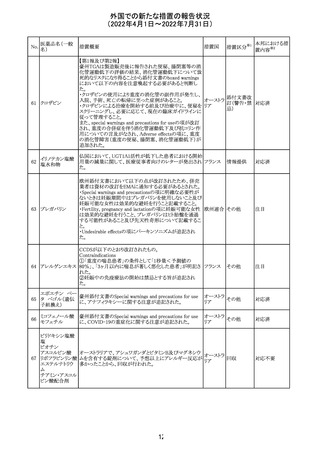
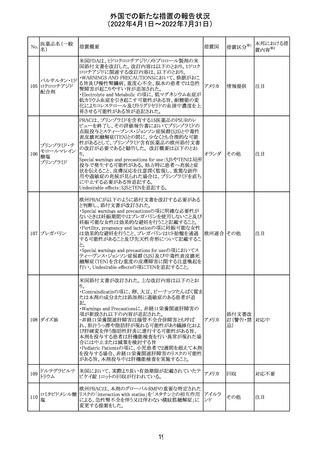
91 イオベルソール
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に、0~3歳の小児患者に
おける甲状腺機能障害が新設され、甲状腺機能低下症ま
たは一過性の甲状腺機能抑制を特徴とする甲状腺機能障
害が報告されている旨、若年層、超低出生体重児、未熟
児、心疾患などは、リスクの増加と関連している旨、心疾患
のある小児患者は、カテーテル検査やコンピューター断層
アメリカ
撮影際に高用量の造影剤を必要とすることが多いため最も
リスクが高い可能性がある旨、 0~3歳の小児患者は、幼少
期の甲状腺機能低下症が運動、聴覚、認知の発達に有害
であり、一過性のT4補充療法を必要とする可能性があるた
め、より綿密なモニタリングが必要でである旨、追記された。
・Adverse Reactionsの項に、0~3歳の小児患者における甲
状腺機能障害が追記された。
・Pediatric Useの項に、上記と同様の内容が追記された。
その他
注目
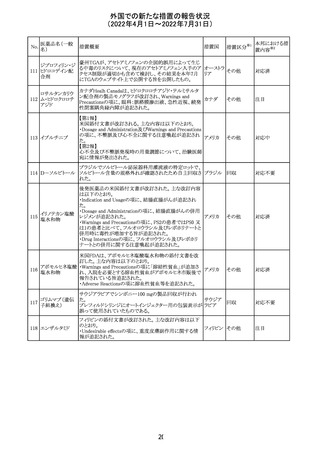
92 セボフルラン
【第1報】
米国FDAは、セボフルランの添付文書を更新することを最
終決定した。変更内容は以下のとおり。
WARNINGS:ダウン症の小児患者において、セボフルラン
による麻酔導入時に先天性心疾患とは関係なく、重篤な徐
脈や心停止のエピソードが報告されていることなどを追記
する。
アメリカ
PRECAUTIONS:ダウン症の小児患者における使用を追記
する。
ADVERSE REACTIONS:Post-Marketing Experienceの項
にダウン症患者における徐脈を追記する。
【第2報】
企業意見欄が変更された。
その他
対応中
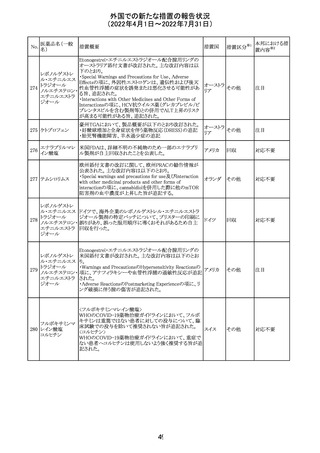
No.
医薬品名(一般
名)
措置概要
措置国
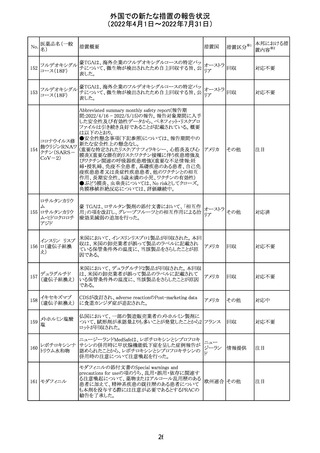
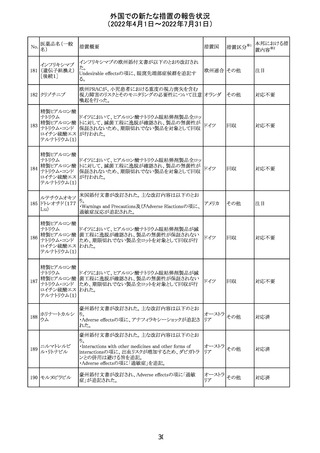
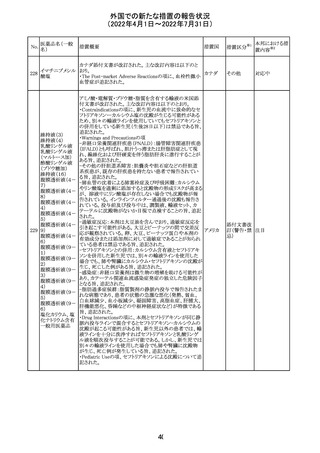
16
(2022年4月1日~2022年7月31日)
措置区分※1
本邦における措
置内容※2
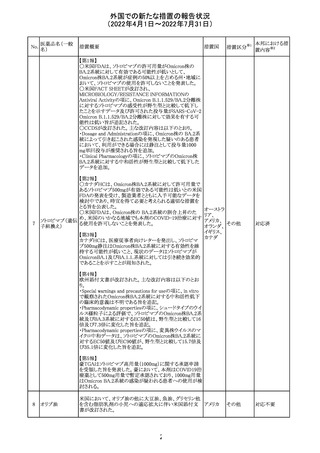
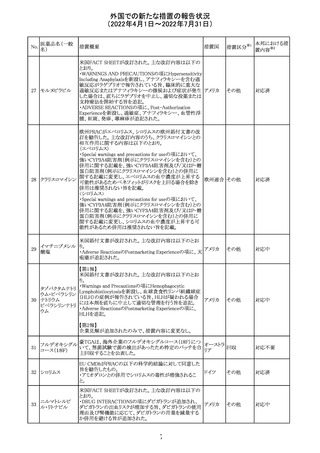
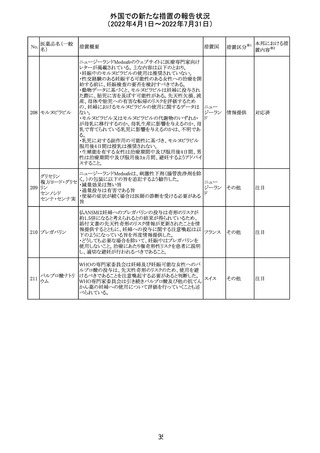
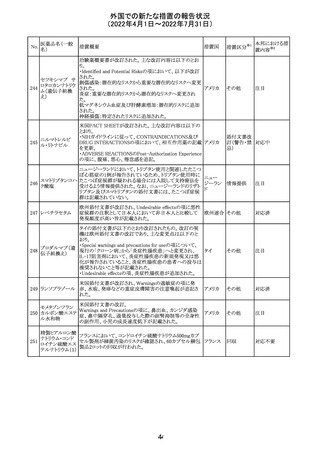
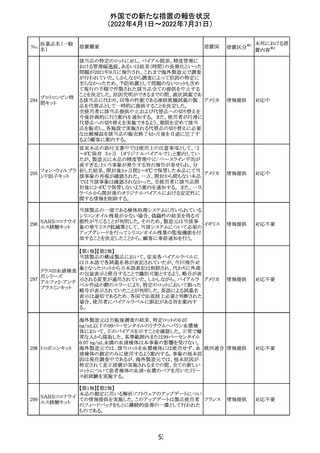
CCDSが改訂されたもの。
①Wanings and Precautionsに「子宮内曝露」の項目が追加
され、以下が追記された。
・子宮内で本剤に曝露した乳児は、生ワクチン接種前に6
か月間の期間を空けることが推奨されること。
・乳児からウステキヌマブが検出されない場合もしくは妊娠
ウステキヌマブ
中の投与が妊娠初期だった場合、臨床的なベネフィットが
89
アメリカ
(遺伝子組換え) あれば生ワクチンの接種も考慮すること
②Interactionの項に、生ワクチンと本剤を併用すべきでな
い旨が追記された。
③Pregnancy, Breast-feeding and Fertilityの項に、公表文
献より、きわめて少量のウステキヌマブが母乳に移行するこ
と、ウステキヌマブは消化管で分解されるため、授乳による
乳児での全身曝露は少量であると予想されること。
その他
注目
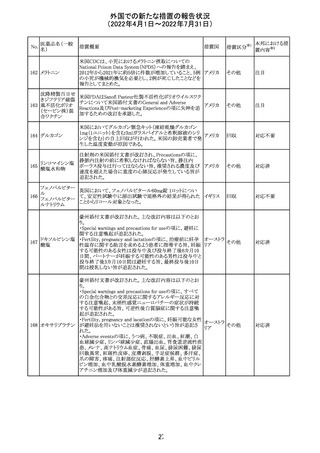
90 アパルタミド
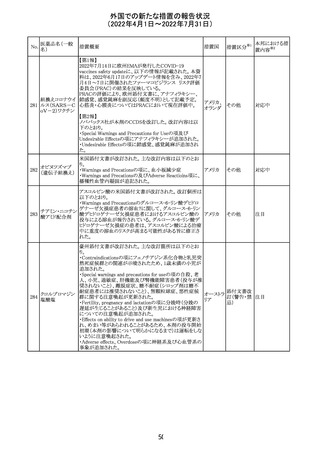
CCDSが改訂される。主な改訂内容は以下のとおり。
・Warning and Precautionsの項に、好酸球増加と全身症状 アメリカ
を伴う薬疹が追記される。
その他
注目
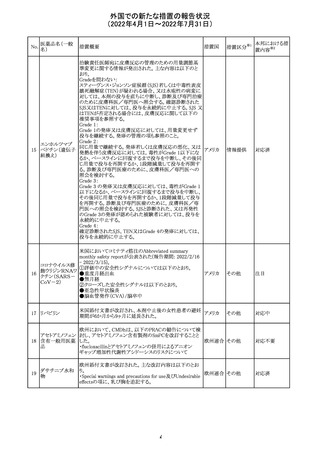
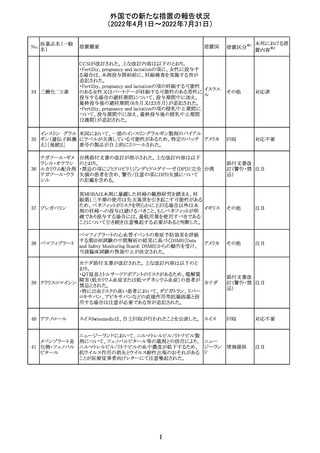
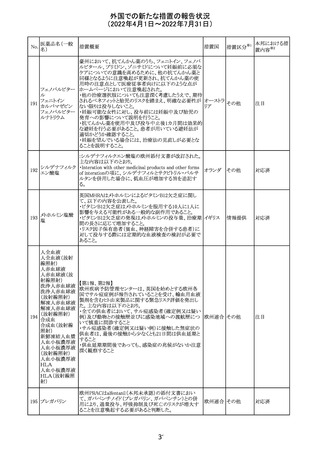
91 イオベルソール
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの項に、0~3歳の小児患者に
おける甲状腺機能障害が新設され、甲状腺機能低下症ま
たは一過性の甲状腺機能抑制を特徴とする甲状腺機能障
害が報告されている旨、若年層、超低出生体重児、未熟
児、心疾患などは、リスクの増加と関連している旨、心疾患
のある小児患者は、カテーテル検査やコンピューター断層
アメリカ
撮影際に高用量の造影剤を必要とすることが多いため最も
リスクが高い可能性がある旨、 0~3歳の小児患者は、幼少
期の甲状腺機能低下症が運動、聴覚、認知の発達に有害
であり、一過性のT4補充療法を必要とする可能性があるた
め、より綿密なモニタリングが必要でである旨、追記された。
・Adverse Reactionsの項に、0~3歳の小児患者における甲
状腺機能障害が追記された。
・Pediatric Useの項に、上記と同様の内容が追記された。
その他
注目
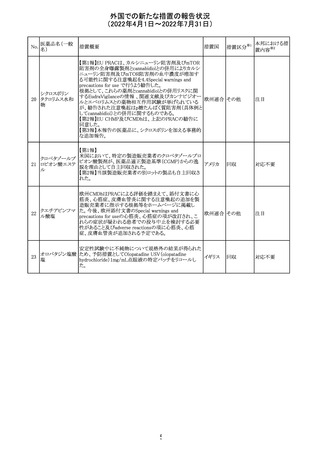
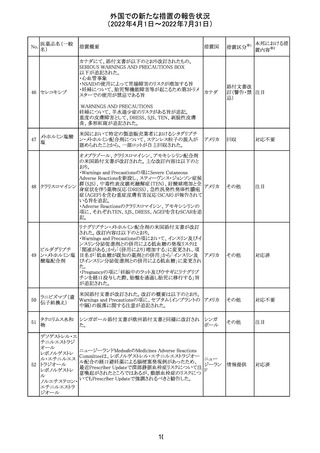
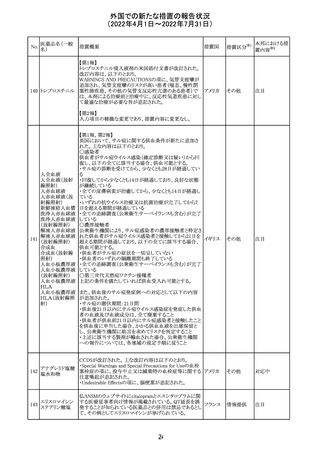
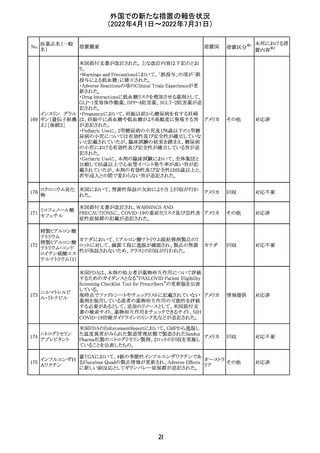
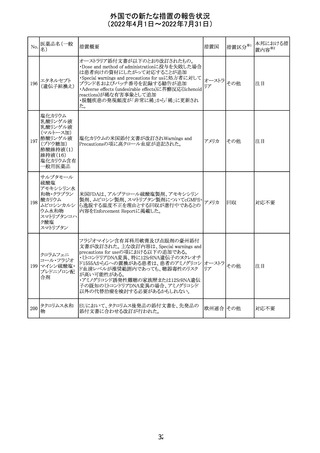
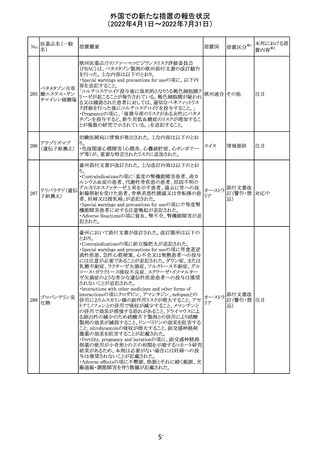
92 セボフルラン
【第1報】
米国FDAは、セボフルランの添付文書を更新することを最
終決定した。変更内容は以下のとおり。
WARNINGS:ダウン症の小児患者において、セボフルラン
による麻酔導入時に先天性心疾患とは関係なく、重篤な徐
脈や心停止のエピソードが報告されていることなどを追記
する。
アメリカ
PRECAUTIONS:ダウン症の小児患者における使用を追記
する。
ADVERSE REACTIONS:Post-Marketing Experienceの項
にダウン症患者における徐脈を追記する。
【第2報】
企業意見欄が変更された。
その他
対応中
No.
医薬品名(一般
名)
措置概要
措置国
16