よむ、つかう、まなぶ。
資料5-3 外国での新たな措置の報告状況 (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29460.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第3回 12/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
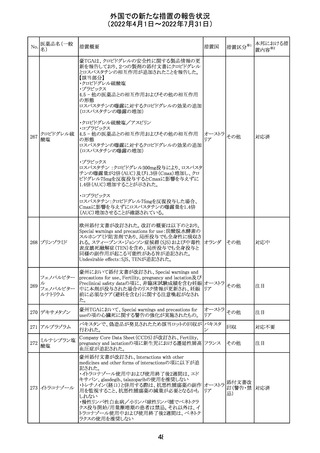
外国での新たな措置の報告状況
(2022年4月1日~2022年7月31日)
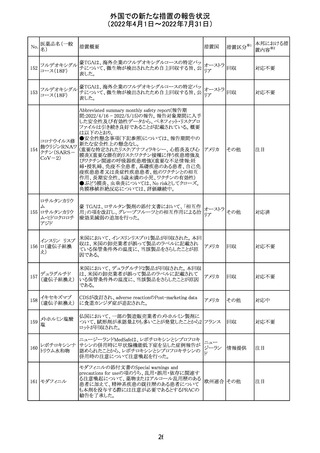
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
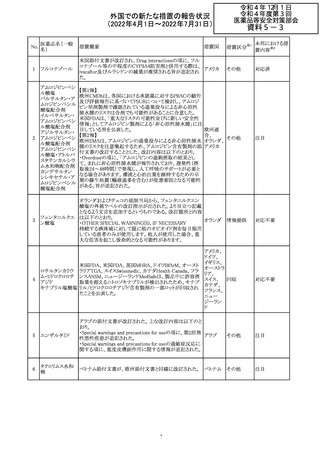
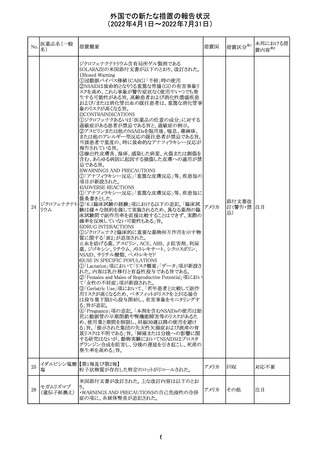
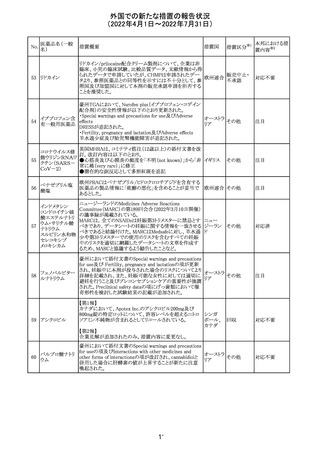
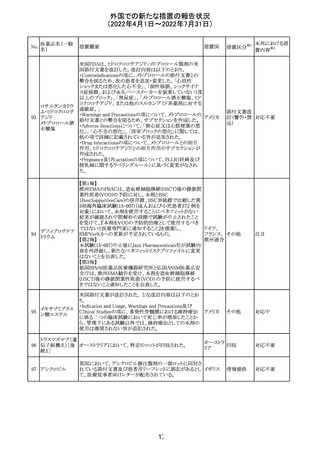
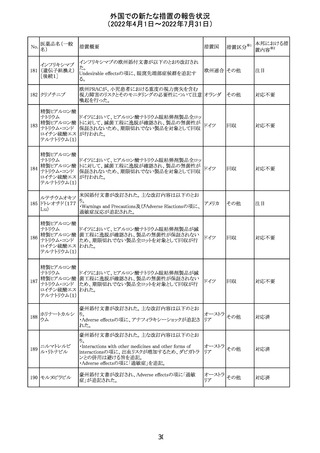
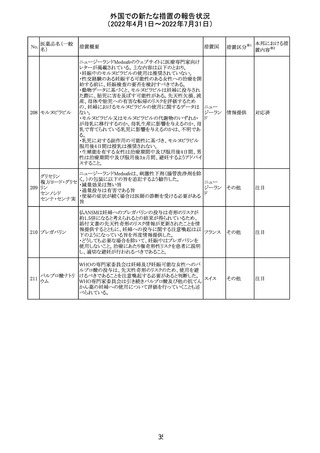
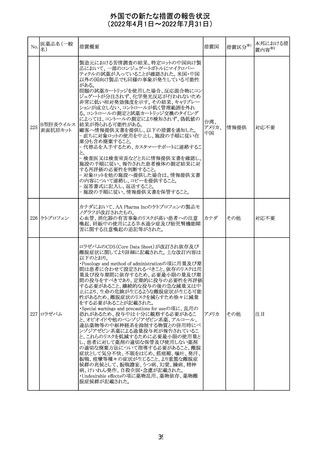
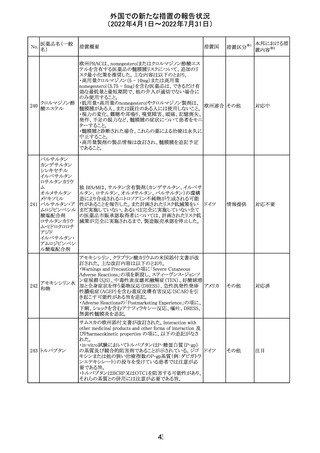
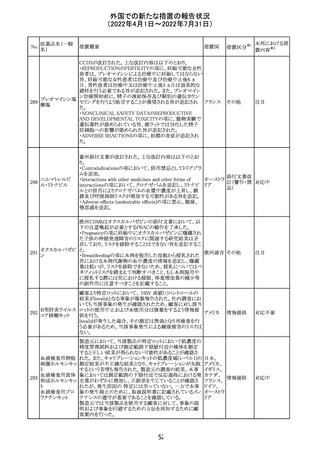
欧州医薬品庁のファーマコビジランスリスク評価委員会
(PRAC)は、ベタメタゾン製剤の欧州添付文書の改訂勧告
を行った。主な内容は以下のとおり。
・Special warnings and precautions for useの項に、以下内
容を追記すること。
ベタメタゾン吉草
「コルチコステロイド投与後に致死的となりうる褐色細胞腫ク
285 酸エステル・ゲン
欧州連合 その他
リーゼが起こることが報告されている。褐色細胞腫が疑われ
タマイシン硫酸塩
る又は確認された患者に対しては、適切なベネフィットリス
ク評価を行った後にコルチコステロイドを投与すること。」
・Pregnancyの項に、「後期早産のリスクがある女性にベタメ
タゾンを投与すると、新生児低血糖症のリスクが増加するこ
とが複数の研究で示されている。」を追記すること。
注目
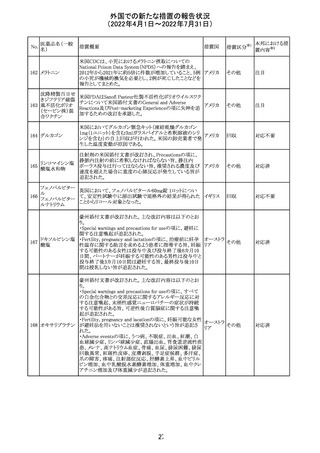
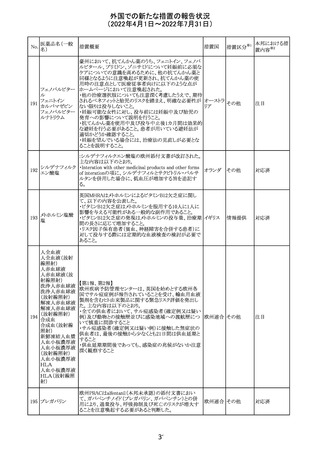
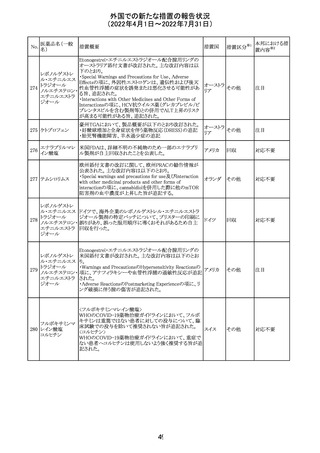
治験医師宛に情報が発出された。主な内容は以下のとお
アテゾリズマブ
り。
286
スイス
(遺伝子組換え) ・免疫関連心膜障害(心膜炎、心嚢液貯留、心タンポナー
デ等)が、重要な特定されたリスクに追加された。
注目
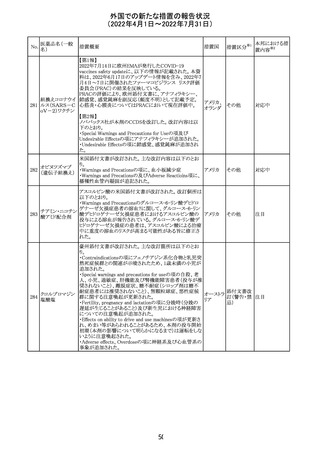
情報提供
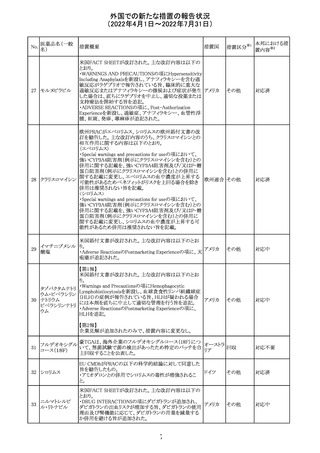
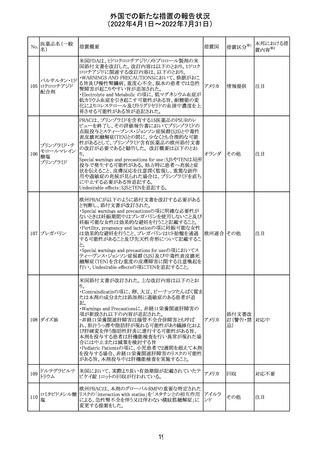
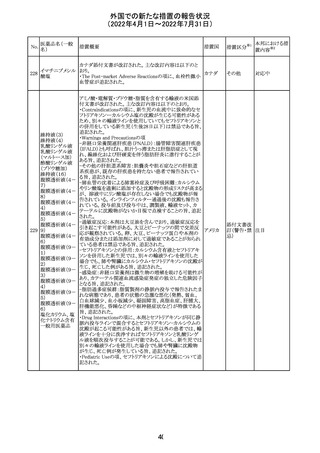
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項に「重度の腎機能障害患者、高カ
ルシウム血症の患者、代謝性骨疾患の患者、原因不明の
アルカリホスファターゼ上昇を示す患者、過去に骨への放
添付文書改
テリパラチド(遺伝
オーストラ
287
射線照射を受けた患者、骨格系悪性腫瘍又は骨転移の患
訂(警告・禁 対応中
子組換え)
リア
者、妊婦又は授乳婦」が追記された。
忌)
・Special warnings and precautions for useの項に中等度腎
機能障害患者に対する注意喚起が追記された。
・Adverse Reactionsの項に貧血、腎不全、腎機能障害が追
記された。
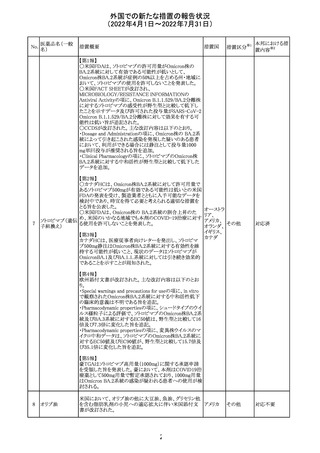
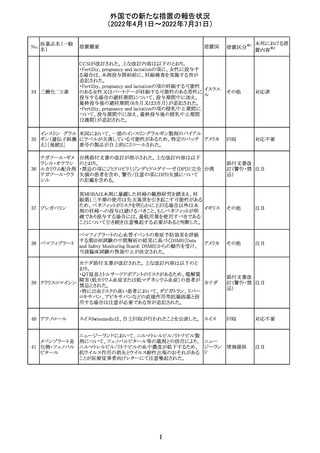
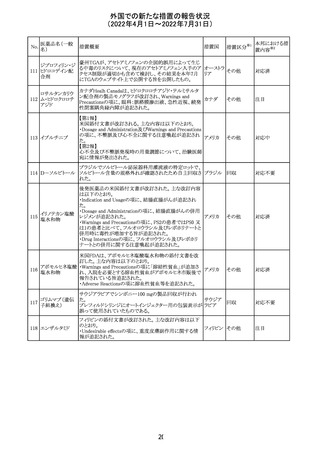
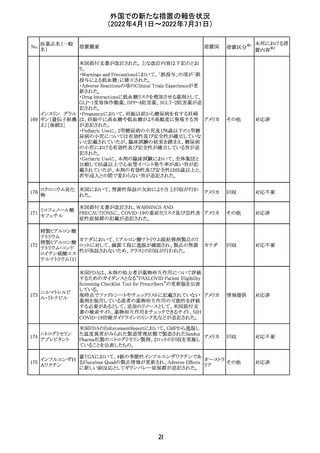
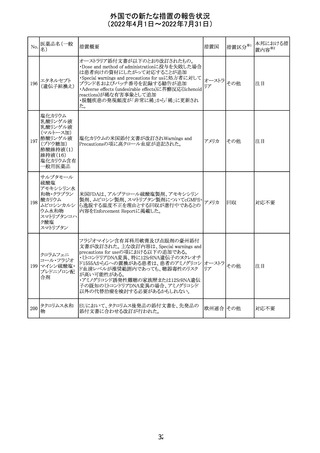
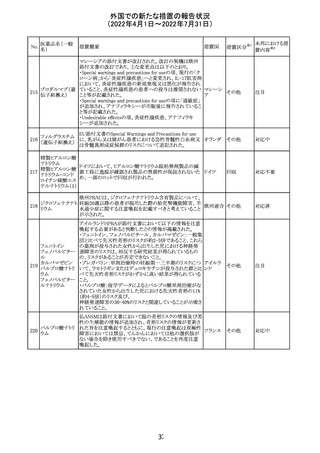
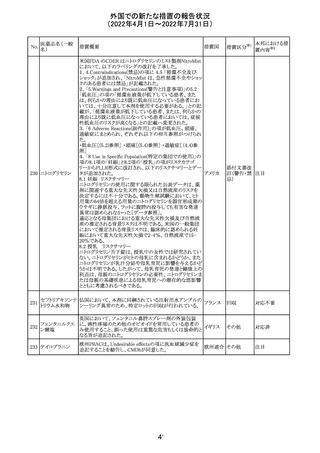
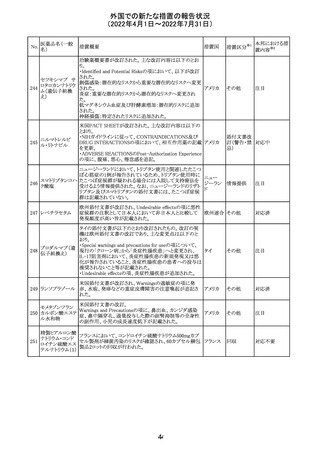
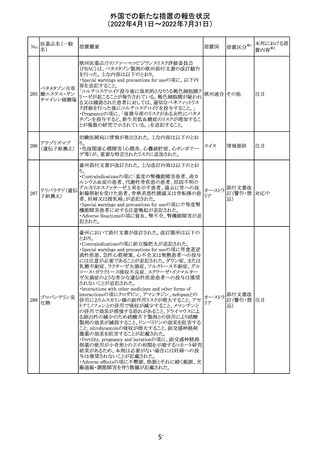
豪州において添付文書が改訂された。改訂箇所は以下の
とおり。
・Contraindicationsの項に前立腺肥大が追記された。
・Special warnings and precautions for useの項に胃食道逆
流性疾患、急性心筋梗塞、心不全又は発熱患者への投与
には注意が必要であることが追記された。ダウン症、または
乳糖不耐症、ラクターゼ欠損症、フルクトース不耐症、グル
コース・ガラクトース吸収不良症、スクラーゼ・イソマルター
ゼ欠損症のような希少な遺伝性疾患患者への投与は推奨
されないことが追記された。
・Interactions with other medicines and other forms of
interactionsの項にクロザピン、アマンタジン、nefopamとの
添付文書改
プロパンテリン臭
オーストラ
288
併用によりムスカリン様の副作用リスクが増大すること、アセ
訂(警告・禁 注目
化物
リア
トアミノフェンとの併用で吸収が減少すること、メマンチンと
忌)
の併用で効果が増強する恐れがあること、ドライマウスによ
る溶出性の減少のため硝酸舌下製剤との併用により硝酸
製剤の効果が減弱すること、ドンペリドンの効果を阻害する
こと、nitrofurantoinの吸収が増大すること、副交感神経刺
激薬の効果を阻害することが記載された。
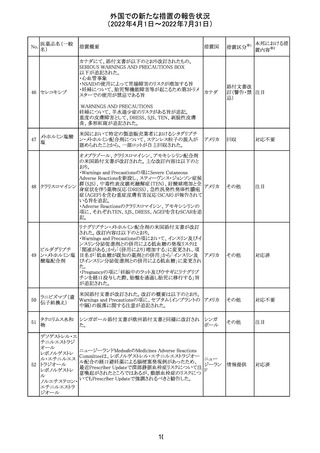
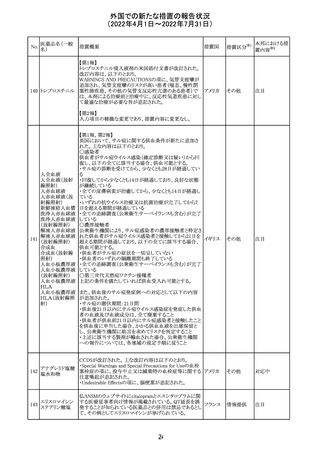
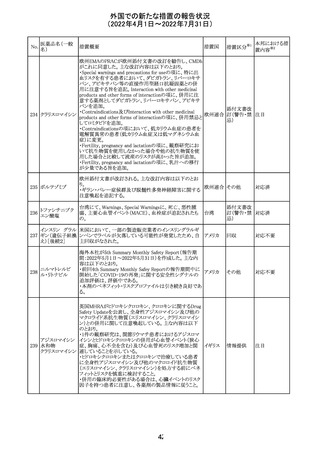
・Fertility, pregnancy and lactationの項に、副交感神経抑
制薬の使用が小奇形との正の相関を示唆するコホート研究
結果があるため、本剤は必要がない場合には妊婦への投
与は推奨されないことが記載された。
・Adverse effectsの項に不整脈、徐脈とそれに続く頻脈、光
線過敏・調節障害を伴う散瞳が記載された。
51
(2022年4月1日~2022年7月31日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
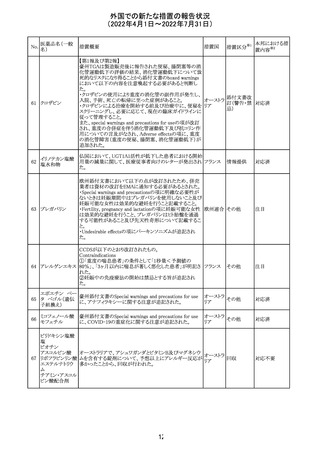
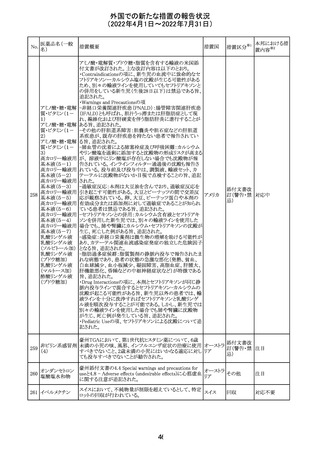
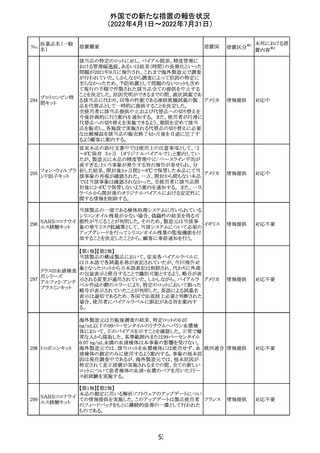
欧州医薬品庁のファーマコビジランスリスク評価委員会
(PRAC)は、ベタメタゾン製剤の欧州添付文書の改訂勧告
を行った。主な内容は以下のとおり。
・Special warnings and precautions for useの項に、以下内
容を追記すること。
ベタメタゾン吉草
「コルチコステロイド投与後に致死的となりうる褐色細胞腫ク
285 酸エステル・ゲン
欧州連合 その他
リーゼが起こることが報告されている。褐色細胞腫が疑われ
タマイシン硫酸塩
る又は確認された患者に対しては、適切なベネフィットリス
ク評価を行った後にコルチコステロイドを投与すること。」
・Pregnancyの項に、「後期早産のリスクがある女性にベタメ
タゾンを投与すると、新生児低血糖症のリスクが増加するこ
とが複数の研究で示されている。」を追記すること。
注目
治験医師宛に情報が発出された。主な内容は以下のとお
アテゾリズマブ
り。
286
スイス
(遺伝子組換え) ・免疫関連心膜障害(心膜炎、心嚢液貯留、心タンポナー
デ等)が、重要な特定されたリスクに追加された。
注目
情報提供
豪州添付文書が改訂された。主な改訂内容は以下のとお
り。
・Contraindicationsの項に「重度の腎機能障害患者、高カ
ルシウム血症の患者、代謝性骨疾患の患者、原因不明の
アルカリホスファターゼ上昇を示す患者、過去に骨への放
添付文書改
テリパラチド(遺伝
オーストラ
287
射線照射を受けた患者、骨格系悪性腫瘍又は骨転移の患
訂(警告・禁 対応中
子組換え)
リア
者、妊婦又は授乳婦」が追記された。
忌)
・Special warnings and precautions for useの項に中等度腎
機能障害患者に対する注意喚起が追記された。
・Adverse Reactionsの項に貧血、腎不全、腎機能障害が追
記された。
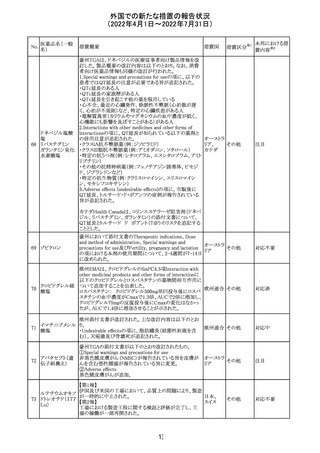
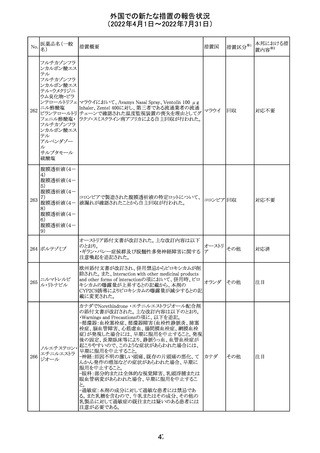
豪州において添付文書が改訂された。改訂箇所は以下の
とおり。
・Contraindicationsの項に前立腺肥大が追記された。
・Special warnings and precautions for useの項に胃食道逆
流性疾患、急性心筋梗塞、心不全又は発熱患者への投与
には注意が必要であることが追記された。ダウン症、または
乳糖不耐症、ラクターゼ欠損症、フルクトース不耐症、グル
コース・ガラクトース吸収不良症、スクラーゼ・イソマルター
ゼ欠損症のような希少な遺伝性疾患患者への投与は推奨
されないことが追記された。
・Interactions with other medicines and other forms of
interactionsの項にクロザピン、アマンタジン、nefopamとの
添付文書改
プロパンテリン臭
オーストラ
288
併用によりムスカリン様の副作用リスクが増大すること、アセ
訂(警告・禁 注目
化物
リア
トアミノフェンとの併用で吸収が減少すること、メマンチンと
忌)
の併用で効果が増強する恐れがあること、ドライマウスによ
る溶出性の減少のため硝酸舌下製剤との併用により硝酸
製剤の効果が減弱すること、ドンペリドンの効果を阻害する
こと、nitrofurantoinの吸収が増大すること、副交感神経刺
激薬の効果を阻害することが記載された。
・Fertility, pregnancy and lactationの項に、副交感神経抑
制薬の使用が小奇形との正の相関を示唆するコホート研究
結果があるため、本剤は必要がない場合には妊婦への投
与は推奨されないことが記載された。
・Adverse effectsの項に不整脈、徐脈とそれに続く頻脈、光
線過敏・調節障害を伴う散瞳が記載された。
51